Farmacovigilancia y seguridad de las vacunas frente al SARS-CoV-2
La gran mayoría de las vacunas manifiestan sus posibles reacciones adversas en los primeros meses tras su administración. Una vez que las vacunas frente a la COVID-19 estén autorizadas, se habrán llevado a cabo estudios en decenas de miles de personas con varios meses de seguimiento, que habrán identificado las reacciones adversas frecuentes.
Dado el número elevado de ciudadanos que han participado en los ensayos clínicos, se estima que han podido identificarse las reacciones adversas más frecuentes. Pero cuando las vacunas se aprueban, el trabajo no ha acabado. Al igual que con el resto de medicamentos, las agencias de medicamentos ponen en marcha sistemas de farmacovigilancia que permiten identificar reacciones adversas que sean muy poco frecuentes o que excepcionalmente puedan ocurrir tras un tiempo de haber recibido la vacuna.
Esta labor de farmacovigilancia en España la realiza la AEMPS de manera coordinada con las comunidades autónomas, el resto de agencias de medicamentos nacionales y la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés). Las agencias de medicamentos de todo el mundo, incluida la AEMPS, han potenciado estos sistemas para vigilar cualquier reacción adversa que pueda producirse, compartir, y analizar la información, y para tomar las medidas que fueran necesarias para mantener favorable la relación entre sus beneficios y sus riesgos potenciales.
- https://www.aemps.gob.es/la-aemps/ultima-informacion-de-la-aemps-acerca-del-covid%E2%80%9119/vacunas-contra-la-covid%E2%80%9119/farmacovigilancia-de-vacunas/
 Farmacovigilancia coordinada con la UE
Farmacovigilancia coordinada con la UE
Todo este sistema trabaja engranado con el resto de países de la Unión Europea en el Comité Europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC) de la EMA,
donde se analizan y estudian estos potenciales nuevos riesgos junto con
toda la información que hubiera disponible al respecto. Además, los
titulares de autorización de comercialización tienen que presentar
informes mensuales sobre todos los datos de seguridad de los que tengan
conocimiento. Las conclusiones que se obtengan de estas evaluaciones son
de aplicación en todos los países de la Unión Europea.
3º Informe de Farmacovigilancia sobre Vacunas COVID-19
- Tras la revisión de los datos disponibles, no se ha identificado ninguna reacción adversa hasta ahora desconocida que pueda ser motivo de preocupación.
- Hasta el 21 de febrero de 2021, se han administrado en España 3.058.776 dosis de vacunas COVID-19, habiéndose recibido 6.266 notificaciones de acontecimientos adversos. Los acontecimientos más frecuentemente notificados siguen siendo los trastornos generales (fiebre, dolor en la zona de vacunación), del sistema nervioso central (cefalea, mareos) y del sistema musculo-esquelético (mialgia y artralgia).
- La AEMPS seguirá informando de los acontecimientos notificados y de cualquier nueva información relevante que pudiera surgir sobre la seguridad de las vacunas frente a la COVID-19.
Introducción
Hasta el 8 de marzo de 2021, se han autorizado en la Unión Europea tres vacunas frente a la COVID-19. Al pulsar en el nombre de cada vacuna se podrá acceder a su ficha técnica.
|
VACUNA |
LABORATORIO |
FECHA AUTORIZACIÓN |
INDICACIONES |
|---|---|---|---|
|
BioNTech/Pfizer |
22 de diciembre de 2020 |
Inmunización activa para prevenir la COVID-19 causada por el virus SARS-CoV-2, en personas de 16 años de edad y mayores. |
|
|
Moderna |
8 de enero de 2021 |
Inmunización activa para prevenir la COVID-19, causada por el virus SARS-CoV-2, en personas de 18 años de edad y mayores. |
|
|
AstraZeneca |
1 de febrero de 2021 |
Inmunización activa para prevenir la COVID-19 causada por el virus SARS-CoV-2, en personas de 18 años de edad y mayores. |
El presente informe incluye datos de los acontecimientos adversos notificados en España tras la administración de vacunas frente a la COVID-19 hasta el 21 de febrero de 2021. Adicionalmente, también se incluye información sobre las conclusiones europeas de la evaluación de los informes de seguridad de la vacuna Moderna y de Comirnaty, así como las respuestas a nuevas preguntas recibidas y la actualización de algunas de las previamente publicadas en la web de la AEMPS.
En España se está vacunando siguiendo una estrategia de vacunación única en todas las CCAA, cuyo contenido se puede consultar en este enlace. Desde el inicio de la campaña de vacunación en España, el 27 de diciembre de 2020, hasta el 21 de febrero de 2021, se han administrado 3.058.776 dosis de vacunas frente a la COVID-19.
España, junto con el resto de países de la Unión Europea, coordinados por la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés), está realizando una vigilancia estrecha para detectar y evaluar posibles nuevas reacciones adversas no identificadas durante los ensayos clínicos de las vacunas frente a la COVID-19.
Datos generales sobre acontecimientos adversos notificados en España tras la vacunación
El Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H), integrado por los Centros Autonómicos de Farmacovigilancia y coordinado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), realiza una valoración permanente de los acontecimientos adversos notificados en España tras la vacunación. Estos acontecimientos adversos se registran en la base de datos FEDRA y el objeto de su análisis es identificar posibles nuevas reacciones adversas que deben someterse a una evaluación más amplia y profunda en la Unión Europea para tener la confirmación de que están ocasionadas por la vacuna.
Es esencial tener presente que un acontecimiento adverso es cualquier problema de salud que ocurre después de la vacunación sin que necesariamente tenga que estar ocasionado por la vacuna, ya que puede tratarse de problemas médicos que coinciden en el tiempo o que estén relacionados con el propio acto de la vacunación.
Los datos que se presentan recogen las notificaciones recibidas en España de acontecimientos adversos ocurridos tras la vacunación frente a la COVID-19 y no se pueden considerar reacciones adversas debidas a la vacuna.
Encontrará más información sobre qué es un acontecimiento adverso y cómo se deben de interpretar estos informes en el siguiente enlace.
Acontecimientos adversos notificados en España hasta el 21 de febrero de 2021 con las vacunas frente a la COVID-19
Hasta el día 21 de febrero de 2021, se han administrado en España 3.058.776 dosis de vacunas frente a la COVID-19, que corresponden a 1.860.403 personas, ya que un 64% recibieron la pauta completa con dos dosis. El 92% de las dosis administradas correspondieron a Comirnaty, el 4% a la vacuna COVID-19 Vaccine Moderna y el 4% a la vacuna COVID-19 Vaccine AstraZeneca (fuente: Registro de Vacunación, Ministerio de Sanidad).
Del total de personas vacunadas, un 72% son mujeres. En cuanto a la distribución por grupos de edad, el 75% corresponde a personas de entre 18 y 64 años y el 25% a mayores de 65 años.
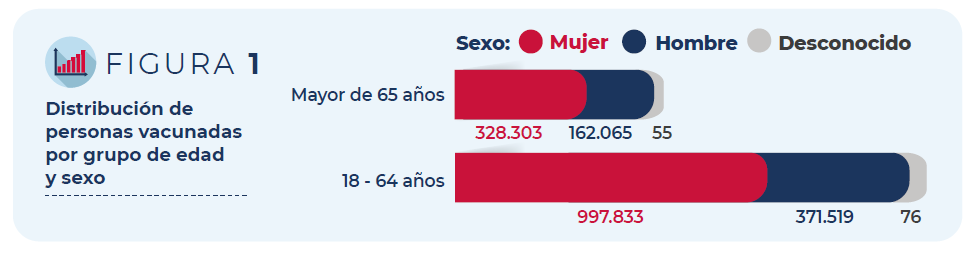
Figura 1: Distribución de personas vacunadas por grupo de edad y sexo
En este periodo se han registrado en la base de datos FEDRA un total de 6.266 notificaciones de acontecimientos adversos, lo que correspondería a 205 notificaciones por cada 100.000 dosis administradas. El 89% han sido comunicadas por profesionales sanitarios, y el 11% a través del formulario dirigido a ciudadanos. La mayoría de las notificaciones procedentes de profesionales sanitarios han sido realizadas por personal médico (46%) o de enfermería (30%). La mayoría de las notificaciones corresponden a mujeres (83%) y a personas de entre 18 y 64 años (91%). Se han notificado dos casos en lactantes cuyas madres se habían vacunado con COVID-19 Vaccine Moderna y Comirnaty.

Figura 2: Distribución de las notificaciones de acontecimientos adversos por grupo de edad y sexo
La notificación de acontecimientos adversos no es una herramienta que pueda utilizarse para calcular la frecuencia de aparición de reacciones adversas en las personas vacunadas, ya que no es una recogida sistemática de datos y como se ha mencionado anteriormente, no se trata de acontecimientos necesariamente relacionados con la vacunación. Tampoco sirve, por tanto, para realizar comparaciones sobre la seguridad de las distintas vacunas.
- Para información más detallada pueden acceder al informe dinámico a través del siguiente enlace.
Información sobre cada vacuna
Comirnaty
-
Conclusiones de la evaluación periódica de los datos de farmacovigilancia
El 25 de febrero, el Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC, por sus siglas en inglés) de la EMA, evaluó el segundo informe mensual de seguridad de Comirnaty, así como una revisión específica sobre reacciones alérgicas graves, concluyendo que el balance beneficio-riesgo de esta vacuna no se ve modificado.
La evaluación identifica la diarrea y los vómitos como nuevas reacciones adversas que pueden aparecer tras la administración de Comirnaty, aunque la frecuencia a la que ocurren se desconoce. La ficha técnica y el prospecto de esta vacuna se actualizará con esta información.
Se han evaluado las notificaciones de anafilaxia, reacción adversa ya conocida, concluyéndose que no es necesario de momento actualizar la ficha técnica y el prospecto de esta vacuna, que ya contiene información acerca de su manejo clínico. No obstante, se seguirá vigilando estrechamente la nueva información de esta reacción adversa.
Los casos con desenlace mortal se analizan mensualmente. La mayoría ocurrieron en pacientes con diversos tratamientos y enfermedades de base cuya progresión explica el desenlace, sin que pueda establecerse relación con la vacuna. En algunos casos, ya se habían iniciado cuidados paliativos para estos pacientes antes de la vacunación. Estos datos no identifican ningún aspecto nuevo sobre la seguridad de esta vacuna.
-
Acontecimientos adversos notificados en España hasta el 21 de febrero de 2021
Hasta el día 21 de febrero de 2021, se han administrado 2.808.344 dosis de Comirnaty, que corresponden a 1.631.448 personas, ya que 1.176.896 recibieron la segunda dosis. La mayoría de las personas vacunadas con Comirnaty son mujeres (72%). En cuanto a la distribución por grupos de edad, el 72% corresponde a personas de entre 18 y 64 años y el 28% a mayores de 65 años (fuente: Registro de Vacunación, Ministerio de Sanidad).
En este periodo se han registrado en FEDRA un total de 5.736 notificaciones de acontecimientos adversos tras recibir Comirnaty, lo que correspondería a 204 notificaciones por cada 100.000 dosis administradas.
La mayoría de las notificaciones corresponden a mujeres (83%) y a personas de entre 18 y 64 años (90%), los grupos que mayoritariamente han recibido esta vacuna.
Las 5.736 notificaciones incluyen 15.387 términos descriptores de acontecimientos adversos. Los trastornos generales como fiebre o dolor en la zona de vacunación siguen siendo los más frecuentemente notificados, seguidos de los trastornos del sistema nervioso (mayoritariamente, cefaleas y mareos) y del sistema musculo-esquelético (principalmente, mialgia y artralgia).
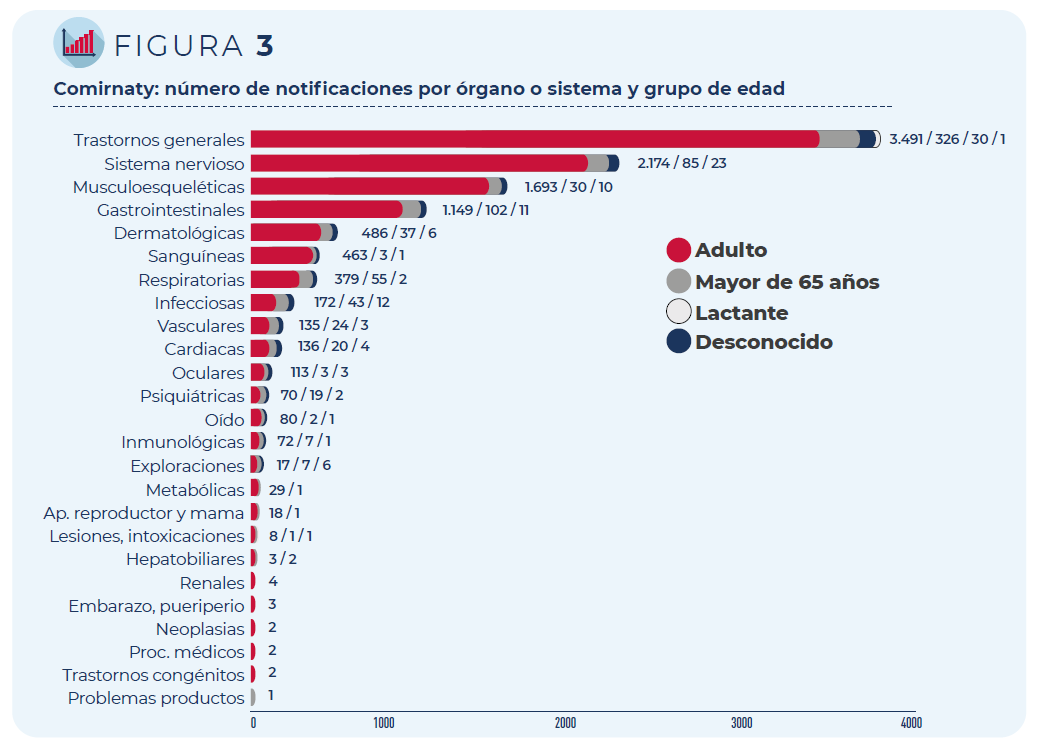
Figura 3. Comirnaty: número de notificaciones por órgano o sistema y grupo de edad
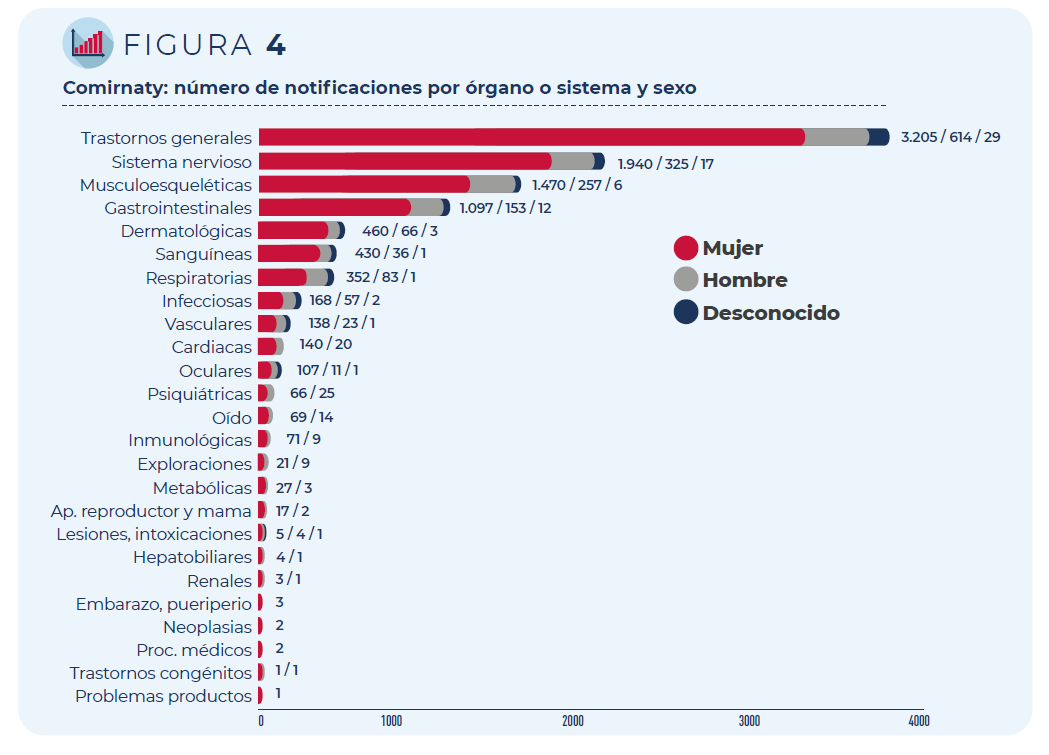
Figura 4. Comirnaty: número de notificaciones por órgano o sistema y sexo
A continuación, se muestran los 10 acontecimientos adversos más notificados, así como su porcentaje con respecto al número total de notificaciones registradas (una notificación puede contener más de un acontecimiento adverso). Todos ellos están ya identificados como reacciones adversas de Comirnaty y, por tanto, están descritos en la ficha técnica y el prospecto de esta vacuna. Son acontecimientos pasajeros que pueden aparecer en los primeros días tras la vacunación.
Tabla 1. Listado de los 10 acontecimientos adversos más notificados con Comirnaty
REACCIÓN (PT)
Nº DE CASOS
PORCENTAJE
Pirexia
2.262
39%
Cefalea
1.653
29%
Mialgia
1.140
20%
Dolor en la zona de vacunación
740
13%
Malestar
732
13%
Náuseas
554
10%
Escalofríos
463
8%
Linfadenopatía
435
8%
Artralgia
433
8%
Fatiga
428
7%
Los casos de anafilaxia notificados en España han sido objeto de revisión en los informes anteriores de la AEMPS. La tasa de notificación se mantiene estable oscilando entre 5-10 casos por millón de dosis administradas.
COVID-19 Vaccine Moderna
-
Conclusiones de la evaluación periódica de los datos de farmacovigilancia
El 25 de febrero, el PRAC evaluó el primer informe mensual de seguridad de esta vacuna, concluyendo que su balance beneficio-riesgo no se ve modificado.
En el mes de enero se notificaron varios casos de reacciones alérgicas graves (anafilaxia) que ocurrieron en un único centro de vacunación en San Diego (Estados Unidos). Aunque todos ocurrieron con el mismo lote de la vacuna, se descartaron problemas de calidad con dicho lote. Las autoridades estadounidenses analizaron los casos de anafilaxia recibidos hasta el 10 de enero tras la administración de la primera dosis de esta vacuna, estimando la tasa notificada en 2,5 casos por millón de dosis administradas.
La anafilaxia está identificada como una reacción adversa conocida y como tal se refleja en la ficha técnica y el prospecto. No obstante, se seguirán vigilando los casos que se notifiquen.
Los acontecimientos adversos con desenlace mortal se analizan mensualmente. La mayoría ocurrieron en pacientes con diversos tratamientos y enfermedades de base cuya progresión explica el desenlace, sin que pueda establecerse relación con la vacuna. En algunos casos, ya se habían iniciado cuidados paliativos para estos pacientes antes de la vacunación. Estos datos no identifican ningún aspecto nuevo sobre la seguridad de esta vacuna.
-
Acontecimientos adversos notificados en España hasta el 21 de febrero de 2021
Hasta el día 21 de febrero de 2021, se administraron un total de 129.602 dosis de COVID-19 Vaccine Moderna, que corresponden a 108.143 personas, ya que 21.459 recibieron la segunda dosis. La mayoría de las personas vacunadas con COVID-19 Vaccine Moderna fueron mujeres (73%). En cuanto a la distribución por grupos de edad, el 97% corresponde a personas de entre 18 y 64 años y el 3% a mayores de 65 años (fuente: Registro de Vacunación, Ministerio de Sanidad).
En este periodo se han registrado en FEDRA un total de 430 notificaciones de acontecimientos adversos tras la administración de la vacuna COVID-19 Vaccine Moderna, lo que correspondería a 332 notificaciones por cada 100.000 dosis administradas.
La mayoría de los casos corresponden a mujeres (84%) y a personas de entre 18 y 64 años (99%), los grupos que mayoritariamente han recibido esta vacuna.
Las 430 notificaciones incluyen 1.254 términos descriptores de acontecimientos adversos. Los trastornos generales como fiebre o dolor en la zona de vacunación han sido los más frecuentemente notificados, seguidos de los trastornos del sistema nervioso (mayoritariamente, cefaleas y mareos) y del sistema musculo-esquelético (artralgia y mialgia).
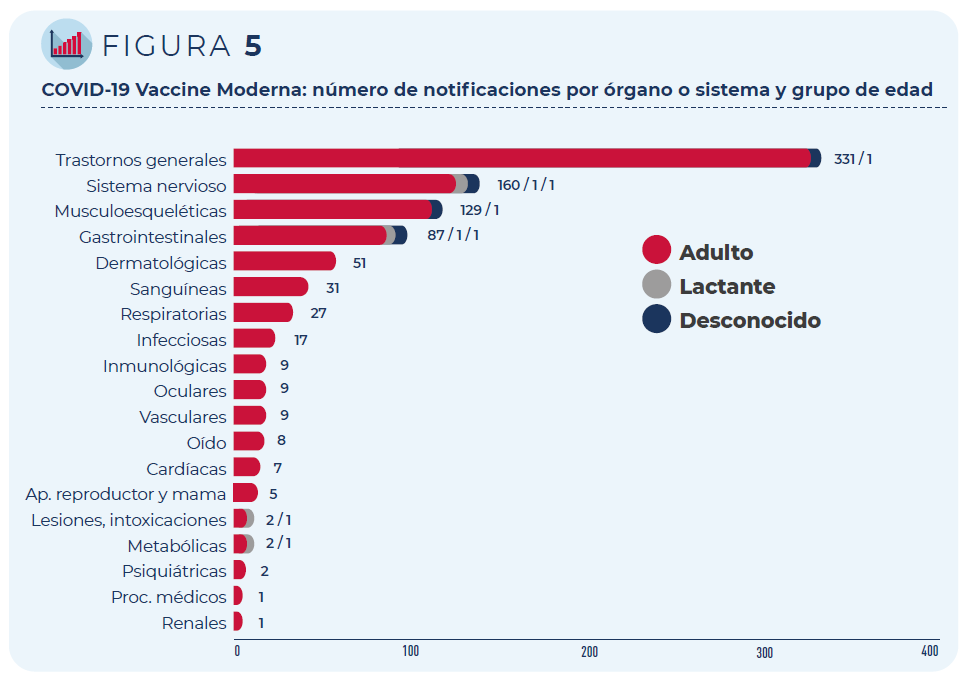
Figura 5: COVID-19 Vaccine Moderna: número de notificaciones por órgano o sistema y grupo de edad
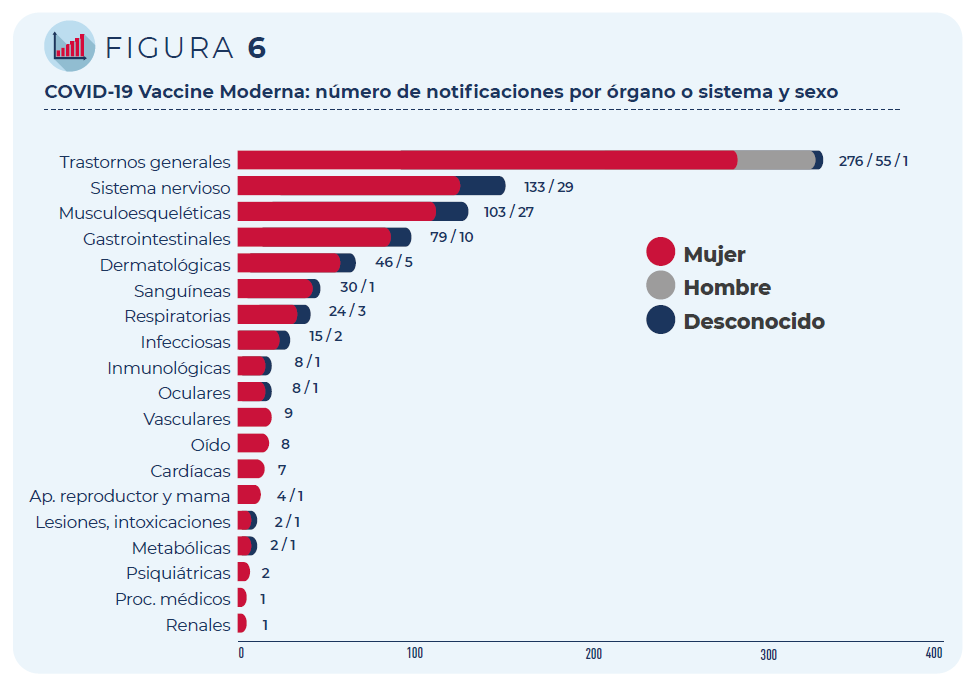
Figura 6: COVID-19 Vaccine Moderna: número de notificaciones por órgano o sistema y sexo
A continuación, se muestran los 10 acontecimientos adversos más notificados, así como su porcentaje con respecto al número total de notificaciones registradas (la notificación puede contener más de un acontecimiento adverso). Todos ellos, salvo malestar y astenia (síntomas inespecíficos motivados por otros acontecimientos como fiebre), constituyen reacciones adversas conocidas para esta vacuna y, por tanto, aparecen ya recogidas en su ficha técnica y prospecto. Son reacciones pasajeras que pueden ocurrir en los primeros días tras recibir la vacuna.
Tabla 2. Listado de los 10 acontecimientos adversos más notificados con COVID-19 Vaccine Moderna
REACCIÓN (PT)
Nº DE CASOS
PORCENTAJE
Pirexia
181
42%
Cefalea
121
28%
Mialgia
73
17%
Dolor en la zona de vacunación
67
16%
Náuseas
45
10%
Malestar
45
10%
Fatiga
34
8%
Escalofríos
32
7%
Linfadenopatía
31
7%
Astenia
28
7%
La anafilaxia es una reacción adversa conocida para esta vacuna, si bien en estos momentos no es posible calcular su tasa notificada en España con cierta fiabilidad, debido al limitado número de dosis administradas hasta el 21 de febrero de 2021.
COVID-19 vaccine AstraZeneca
-
Conclusiones de la evaluación periódica de los datos de farmacovigilancia
Dada su reciente autorización, la evaluación del primer informe de seguridad mensual aún no está disponible.
-
Acontecimientos adversos notificados en España hasta el 21 de febrero de 2021
Hasta el día 21 de febrero de 2021, se administraron un total de 120.830 dosis de COVID-19 Vaccine AstraZeneca. La mayoría de las personas vacunadas con COVID-19 Vaccine AstraZeneca fueron mujeres (67%) y todas con edades comprendidas entre los 18 y 64 años (fuente: Registro de Vacunación, Ministerio de Sanidad).
En este periodo se han registrado en FEDRA un total de 84 notificaciones de acontecimientos adversos con COVID-19 Vaccine AstraZeneca, lo que correspondería a 69 notificaciones por cada 100.000 dosis administradas.
La mayoría de los casos corresponden a mujeres (87%) y todos ellos se han notificado en personas de entre 18 y 64 años.
Las 84 notificaciones incluyen 267 términos descriptores de acontecimientos adversos. Los trastornos generales como fiebre o dolor en la zona de vacunación han sido los más frecuentemente notificados, seguidos de los trastornos del sistema nervioso (mayoritariamente, cefaleas y mareos) y del sistema musculo-esquelético (artralgia y mialgia).
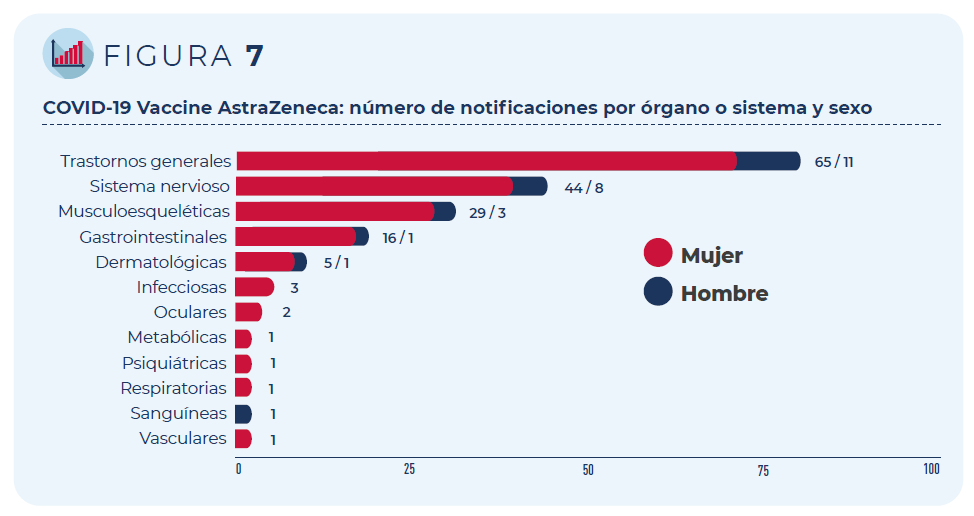
Figura 7: COVID-19 Vaccine AstraZeneca: número de notificaciones por órgano o sistema y sexo
Los 10 acontecimientos adversos más notificados aparecen en la siguiente tabla, así como su porcentaje con respecto al número total de notificaciones registradas (la notificación puede contener más de un acontecimiento adverso). Todos ellos, salvo astenia (síntoma inespecífico que acompaña a otros acontecimientos), constituyen reacciones adversas conocidas para esta vacuna y, por tanto, aparecen ya recogidas en su ficha técnica y prospecto. Son reacciones pasajeras que pueden ocurrir en los primeros días tras la vacunación.
Tabla 3. Listado de los 10 acontecimientos adversos más notificados con COVID-19 Vaccine AstraZeneca
REACCIÓN (PT)
Nº DE CASOS
PORCENTAJE
Pirexia
69
82%
Cefalea
43
51%
Mialgia
26
31%
Dolor en la zona de vacunación
18
21%
Malestar
13
15%
Escalofríos
12
14%
Náuseas
9
11%
Mareo
6
7%
Astenia
6
7%
Fatiga
6
7%
- Agradecemos su colaboración notificando los acontecimientos adversos tras la vacunación frente a la COVID-19. Estas notificaciones, junto con las registradas en otros países, se analizan para identificar posibles nuevos riesgos y forman parte de las evaluaciones periódicas del Comité Europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC, por sus siglas en inglés).
- Si tiene que priorizar recuerde que, al igual que con los otros medicamentos, interesan especialmente los acontecimientos adversos graves o no conocidos.
- Para más información sobre la notificación de acontecimientos adversos, pulse el siguiente enlace.
Respuestas a preguntas frecuentes sobre seguridad de las vacunas frente a la COVID-19 (nuevas o actualizadas)
Puede consultar todas las respuestas a preguntas frecuentes relacionadas con la seguridad de vacunas frente a la COVID-19 en el siguiente enlace.
- Para recibir próximos Informes de Farmacovigilancia de Vacunas COVID-19, suscríbase aquí.
- https://www.aemps.gob.es/informa/boletines-aemps/boletin-fv/2021-boletin-fv/3o-informe-de-farmacovigilancia-sobre-vacunas-covid-19/
Farmacovigilancia y seguridad de las vacunas frente al SARS-CoV-2
La gran mayoría de las vacunas manifiestan sus posibles reacciones adversas en los primeros meses tras su administración.
Dado el número elevado de ciudadanos que han participado en los ensayos clínicos de la vacuna frente al SARS-CoV-2, se estima que han podido identificarse las reacciones adversas más frecuentes. Pero al igual que con el resto de medicamentos, las agencias de medicamentos ponen en marcha sistemas de farmacovigilancia que permiten identificar reacciones adversas que sean muy poco frecuentes o que excepcionalmente puedan ocurrir tras un tiempo de haber recibido la vacuna. (ver Nota Informativa MUH (FV), 18/2020 de la AEMPS de Vigilancia de la seguridad de las vacunas frente a la COVID-19).
La notificación de acontecimientos adversos que puedan ocurrir tras la vacunación, se lleva a cabo a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H). Los profesionales de la salud y los propios ciudadanos pueden notificarlos en el formulario electrónico disponible en la web www.notificaRAM.es. Esta la herramienta más útil para identificar potenciales nuevas reacciones adversas. Por ello, se recuerda tanto a profesionales sanitarios y a la ciudadanía la importancia de estas notificaciones. Se puede consultar más información general sobre ello en este enlace: Notificación de acontecimientos adversos con las vacunas frente a la COVID-19.
| La información sobre la sospecha de reacciones adversas causadas por la vacunación debe quedar registrada en la historia clínica de la persona vacunada. Así, la vigilancia de la seguridad de estas vacunas pueda realizarse con la mejor información y además se incorpora a las bases de datos diseñadas para la seguridad de los medicamentos, como BIFAP (ver Nota Informativa de la AEMPS MUH (FV), 19/2020 El programa BIFAP en la vigilancia de la seguridad de las vacunas frente a la COVID-19). |
Registro en la Historia Clínica de Sacyl de las reacciones adversas asociadas a la vacuna
A través del Visor Clínico de Medora, se accede al módulo de vacunas, que es donde se registran las vacunas administradas a cada paciente con la fecha de cada dosis por cada tipo de vacuna:
Si se tiene la sospecha de que hay una reacción adversa asociada a la administración de una vacuna, hay que clicar sobre la celda con la fecha de administración de la dosis (en la imagen, la celda verde). Así, se despliega un cuadro con los detalles de la vacunación. En el apartado de Reacciones, clicando en el triángulo (en el que aparece el mensaje "agregar reacción adversa") se puede introducir manualmente una breve descripción de la sospecha de la reacción adversa. Clicando en el botón de Notificación RAM, se accede a la página de la AEMPS del sistema español de farmacovigilancia (1).
https://www.saludcastillayleon.es/portalmedicamento/es/noticias-destacados/destacados/farmacovigilancia-seguridad-vacunas-frente-sars-cov-2
Seguridad de las vacunas. Contraindicaciones y precauciones
- Puntos clave
- Introducción
- Evaluación de la seguridad de las vacunas
- Sistemas de monitorización de la seguridad de las vacunas
- Problemas específicos relacionados con la seguridad de las vacunas
- Contraindicaciones y precauciones de las vacunas
- Falsas contraindicaciones
- Bibliografía
- Enlaces de interés
- Historial de actualizaciones
- Tablas y figura incluidas en el capítulo
Tabla 3.1. Tipos de reacciones vacunales
Tabla 3.2. Evaluación
de la seguridad de las vacunas. Fases de los ensayos clínicos con sus
principales objetivos y farmacovigilancia poscomercialización
Tabla 3.3. Puntos clave para la evaluación de la causalidad de un evento adverso relacionado con vacunas
Tabla 3.4. Falsas contraindicaciones y precauciones frente a las vacunas
Figura 3.1. Clasificación de los efectos adversos relacionados con la vacunación
Sugerencia para la citación: Comité Asesor de Vacunas (CAV-AEP). Seguridad de las vacunas. Contraindicaciones y precauciones. Manual de vacunas en línea de la AEP [Internet]. Madrid: AEP; feb/2021. [consultado el dd/mmm/aaaa]. Disponible en: http://vacunasaep.org/documentos/manual/cap-3
1. Puntos clave
- Las vacunas actuales tienen un satisfactorio perfil de seguridad, muy por encima del resto de medicamentos. A pesar de ello, cuando se vacuna a una gran cantidad de población pueden aparecer efectos adversos, la mayoría de ellos leves y poco frecuentes. Para el control de los mismos existen en todos los países sistemas de declaración o notificación de posibles efectos adversos relacionados con la administración de las vacunas. Es muy importante que el personal sanitario implicado en la vacunación participe activamente en esta monitorización.
- Garantizar la seguridad de las vacunas en condiciones reales de uso, con una estrecha monitorización de su utilización, permite mantener la confianza en la vacunación y es imprescindible para conseguir una correcta aceptación de las campañas de vacunación y obtener el máximo beneficio para toda la población.
- Es imprescindible conocer las contraindicaciones y las precauciones de las vacunas para minimizar los posibles riesgos de su administración.
- Es necesario saber las falsas contraindicaciones para así evitar las oportunidades perdidas de vacunación.
2. Introducción
Las vacunas constituyen un apartado especial dentro de los fármacos: a diferencia de los demás, se administran a personas sanas para evitar enfermedades y por ello es necesario que las mismas no causen, como mínimo, más daños de los que podría ocasionar la propia enfermedad; es decir, el beneficio obtenido debe ser mayor al riesgo de presentar una reacción adversa asociada a su administración. Por ello deben ser lo más seguras posibles.
Las vacunas y, en concreto, los programas de vacunación son una de las estrategias preventivas más beneficiosas en salud pública.
Las vacunas, como cualquier otro producto biológico o farmacéutico, no están exentas de reacciones adversas. En su gran mayoría son leves, bien toleradas y aceptables, aunque en raras ocasiones pueden producirse efectos de mayor gravedad.
Algunas de las reacciones adversas de las vacunas son tan raras que solo se aprecian después de una amplia utilización posterior a su aprobación y comercialización. Por eso es del máximo interés el seguimiento de los efectos adversos poscomercialización, que permiten completar el conocimiento sobre su seguridad.
Las vacunas se administran habitualmente a población sana, sobre todo a niños, y por ello las garantías de seguridad que se les exigen son máximas. Las consideraciones sobre la seguridad de las vacunas se evalúan con gran rigor científico y las decisiones sobre su administración a la población deben basarse en un conocimiento preciso del cociente beneficio/riesgo de cada vacuna, garantizando que los beneficios de la vacunación para los individuos y para la comunidad sean claramente superiores a los riesgos, teniendo en cuenta además la carga sociosanitaria, la morbilidad y la mortalidad de la enfermedad que se pretende prevenir.
Las reacciones adversas o eventos adversos son tan antiguos como los primeros remedios utilizados en el tratamiento de las enfermedades. Todo producto con actividad farmacológica puede actuar como tratamiento, pero también como veneno. Ningún producto biológico o farmacéutico desarrollado hasta ahora es 100 % seguro y 100 % eficaz.
Se considera evento adverso (EA) a cualquier incidente médico asociado a la administración de una sustancia medicamentosa o droga (por ej. una vacuna) de manera temporal, sin que exista necesariamente una relación causal entre ambos.
Una reacción adversa (RA) medicamentosa es cualquier efecto nocivo, no deseado y no intencional de una droga, que se presenta cuando la misma se utiliza a dosis normalmente usadas en los seres humanos para la profilaxis, diagnóstico, tratamiento de una enfermedad o para la modificación de una función fisiológica. En este caso, y a diferencia del evento adverso, existe una posibilidad razonable de que haya una relación causal entre el fármaco y la experiencia adversa.
Las vacunas, como sustancias medicamentosas de indicación preventiva o
terapéutica, están incluidas como causa de ambos conceptos.
Los EA incluyen tanto las RA como los efectos adversos derivados de los
errores de administración, los efectos nocivos, la intoxicación
accidental o intencionada o el no cumplimiento de la terapia
farmacológica.
Por tanto, las RA tras la vacunación pueden considerarse un tipo de EA en el que se sospecha una relación causal entre la administración de una vacuna y el efecto observado.
A pesar de estas definiciones y a título práctico, utilizaremos el término reacción adversa para hacer referencia a la clasificación global de las mismas en el contexto de las vacunas, sin establecer diferencias semánticas entre evento y reacción.
Las reacciones adversas siguientes a la vacunación pueden clasificarse, en función de su causa. La OMS las clasifica en cinco categorías, reflejadas en la tabla 3.1 y en la figura 3.1.
Tabla 3.1. Tipos de reacciones vacunales. (OMS*)
| Tipos de reacciones vacunales |
| a. Reacciones inducidas por la vacunación (incluyendo reacciones alérgicas). Respuesta individual producida por las propiedades inherentes al producto, cuando la vacuna ha sido correctamente manipulada y administrada. |
| b. Reacciones por defectos en la calidad de la vacuna |
| c. Reacciones debidas a errores de programa: errores en el almacenamiento, manipulación o administración. A diferencia de la anterior, se puede prevenir y evitar. |
| d. Reacciones debidas a procesos ansiosos relacionados con el acto vacunal. No relacionadas con el producto, pero sí con el “miedo al acto vacunal”. Los 4 tipos más frecuentes descritos son: desmayo (síncope), hiperventilación (mareos, cefalea, hormigueo de manos y boca), vómitos y convulsiones. |
| e. Eventos coincidentes. No relacionados con la vacuna. |
| f. Reacciones idiosincrásicas o de causa desconocida. |
Figura 3.1. Clasificación de los efectos adversos relacionados con la vacunación. (OMS*)
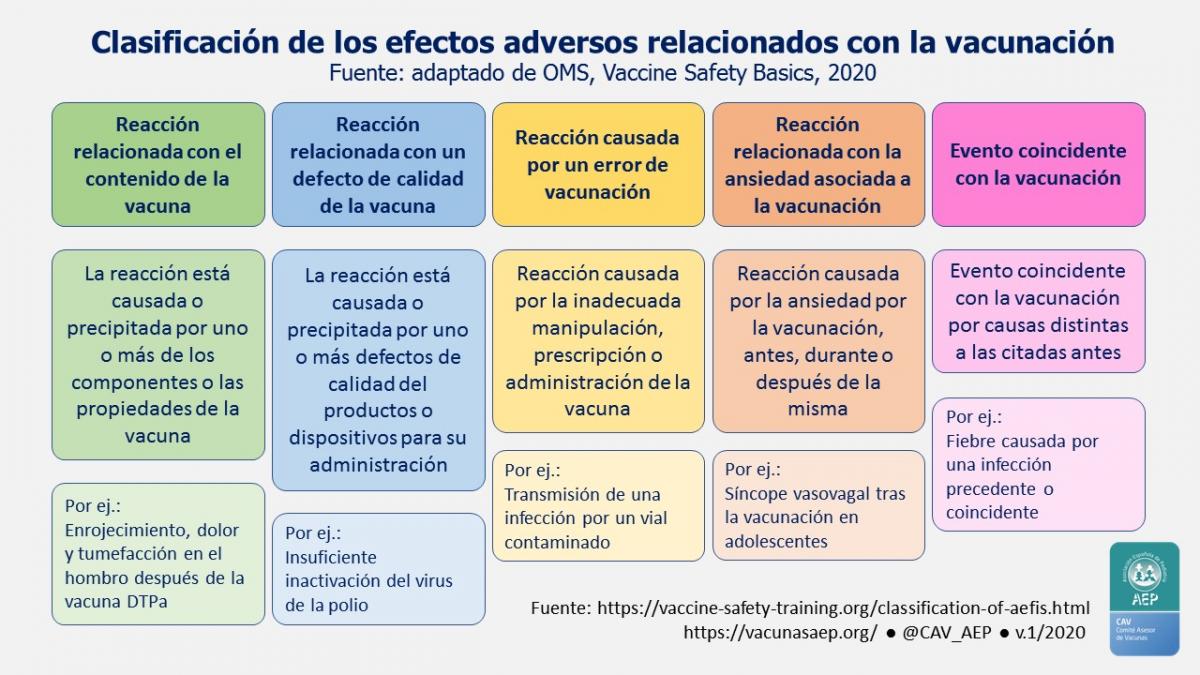
* Modificado de WHO E-learning course on Vaccine Safety Basics.
Es importante conservar y fomentar en la población la confianza en las vacunas. A lo largo de la historia de la vacunación se han observado en distintos países (Japón, Reino Unido, Francia, etc.) fenómenos de pérdida de confianza en la vacunación, relacionados con informaciones que cuestionaron la seguridad de algunas de ellas (tosferina, sarampión, hepatitis B) y que llevaron a una disminución de las coberturas de vacunación. Estas situaciones ocasionaron la reaparición de brotes de enfermedades inmunoprevenibles, con morbilidad y, en ocasiones, con mortalidad significativa. En la actualidad, los casos de sarampión han aumentado sustancialmente en Europa en los últimos años, alcanzando un número inaceptable de casos y muertes evitables.
Divulgar exhaustivamente entre la población los conocimientos de la elevada seguridad de las vacunas es tarea necesaria y obligada para todos los profesionales sanitarios.
3. Evaluación de la seguridad de las vacunas
La monitorización de la seguridad de las vacunas es uno de los requerimientos más importantes exigido por las autoridades sanitarias para otorgar la autorización de su comercialización.
La seguridad de las vacunas se vigila tanto en los estudios realizados durante el desarrollo de las mismas (precomercialización) como en la vigilancia continuada tras su comercialización (poscomercialización). Los estudios poscomercialización son esenciales para garantizar su seguridad en condiciones reales de uso y permiten, tras la administración sistemática a un elevado número de personas, detectar reacciones adversas infrecuentes, potencialmente graves, y cuantificar su adecuado perfil beneficio/riesgo.
Una de las dificultades para analizar la seguridad de las vacunas es que no puede medirse directamente, solo puede ser inferida de la ausencia relativa de sus efectos adversos. Por ese motivo, la vigilancia de seguridad de cualquier fármaco, incluidas las vacunas, se mantiene durante todo el tiempo, desde el inicio de su desarrollo y mientras continúe comercializado.
Estudios precomercialización
Los ensayos clínicos son la primera fuente que aporta los conocimientos de la seguridad de una nueva vacuna.
Los ensayos clínicos, que implican la participación de seres humanos, están sujetos a una normativa internacional de calidad científica y ética dirigida al diseño, realización, registro y redacción de informes de este tipo de estudios, denominada Guía de Buena Práctica Clínica (GBPC) (ver capítulo: Investigación en Vacunas). El cumplimiento de esta norma asegura la protección de los derechos, la seguridad y el bienestar de los individuos participantes, y garantiza la calidad científica de los datos obtenidos en un ensayo clínico.
El cumplimiento de las normas de la GBPC garantiza a su vez la adecuación de la investigación a los principios éticos de la Declaración de Helsinki de la Asociación Médica Mundial que rigen la realización de las investigaciones biomédicas en seres humanos y cuyo escrupuloso cumplimiento permite que dichos estudios sean aceptados por las autoridades de la mayoría de los países.
En la tabla 3.2 se resumen cuáles son los objetivos a cumplir y el número de pacientes que es necesario reclutar en cada fase del desarrollo de una vacuna.
En todas las fases del desarrollo clínico de una nueva vacuna se evalúa, en términos de seguridad, la reactogenicidad y los problemas que pudieran surgir respecto otras reacciones adversas que pudieran poner en duda la idoneidad de la vacuna para proseguir su desarrollo.
Tabla 3.2. Evaluación de la seguridad de las vacunas. Fases de los ensayos clínicos con sus principales objetivos y farmacovigilancia poscomercialización.
| Fase | Número de sujetos1 | Objetivos prioritarios |
|---|---|---|
| I | 10-100 |
|
| II | 100-1500 |
|
| III | 300-60 000 |
|
| IV (poscomercialización) | 100 a varios miles2 |
|
| Vigilancia poscomercialización | Población general (millones) |
|
1 El número de sujetos participantes es orientativo y puede variar en función del tipo de vacuna y la estrategia de desarrollo.
2 Muy variable según los objetivos del estudio.
La aprobación de cualquier vacuna está condicionada a la comprobación exhaustiva, por parte de estas agencias reguladoras, de la idoneidad de los estudios realizados, la confirmación de la obtención de datos de calidad suficientes en el desarrollo clínico del producto y una evaluación final del cociente beneficio/riesgo de la nueva vacuna.
Solo para situaciones de emergencia, como la que se produjo ante la pandemia de gripe A H1N1 en el año 2009, están establecidos procedimientos de registro acelerado, que acortan los plazos habituales de evaluación a los que se comprometen las agencias, establecen la documentación básica exigida sin exclusión de los requerimientos sobre seguridad y se enfatiza la decisión según una adecuada evaluación del cociente beneficio/riesgo.
Vigilancia de la seguridad posterior a la aprobación
Es uno de los aspectos de mayor interés tras la introducción de cualquier producto farmacéutico y, concretamente, de una herramienta preventiva de aplicación masiva como es la vacunación. Estos estudios se justifican porque:
- Los ensayos clínicos no tienen poder estadístico suficiente para detectar los posibles efectos adversos muy infrecuentes.
- La necesidad de monitorizar las vacunas tras su utilización extendida en la población que son excluidos de los ensayos clínicos: personas con enfermedades crónicas, con determinados tratamientos farmacológicos, niños prematuros y embarazadas.
- La posibilidad en la práctica diaria de que se administren vacunas fuera del rango de edad recomendado.
4. Sistemas de monitorización de la seguridad de las vacunas
La modalidad fundamental de monitorización de los efectos secundarios de las vacunas es el sistema de notificación espontánea (SNE), en el que todos los profesionales sanitarios, y especialmente los que se dedican a la administración de vacunas en atención primaria, deben implicarse:
- Es una herramienta de primera línea para mejorar los conocimientos de la seguridad de las vacunas.
- Todas las reacciones sospechosas que ocurren tras la inmunización se definen como efectos adversos, lo que no implica necesariamente su relación causal con la vacuna.
- Las pruebas de causalidad se establecen mediante estudios epidemiológicos complejos que permiten detectar un riesgo elevado de un determinado incidente en individuos vacunados en comparación con individuos no vacunados, especialmente cuando se consigue definir un periodo de riesgo específico entre la vacunación y el efecto, o cuando es posible confirmar su plausibilidad biológica.
En EE. UU., el sistema de comunicación espontáneo de efectos adversos de las vacunas, Vaccine Adverse Event Reporting System (VAERS), está combinado con dos sistemas de vigilancia activa que se encargan de la monitorización de la seguridad de las vacunas tras su comercialización: el Vaccine Safety Datalink (VSD), que es un proyecto colaborativo entre los Centers for Disease Control and Prevention (CDC) y ocho organizaciones sanitarias, y el Clinical Immunization Safety Assessment (CISA), que también es un proyecto colaborativo de seis centros académicos de EE. UU. El VAERS recibe anualmente más de 13 000 comunicaciones de efectos adversos que son evaluadas con el fin de confirmar o descartar que exista relación alguna con las vacunas.
En España, los efectos adversos a fármacos, incluidas las vacunas, se notifican al sistema de farmacovigilancia de la AEMPS mediante las tarjetas amarillas de declaración voluntaria y espontánea. Cada año se reciben entre 600-800 efectos adversos supuestamente relacionados con la administración de las vacunas, que son posteriormente evaluados por la propia agencia y compartidos con otras bases de datos de la EMA y de la OMS.
La OMS, con el objetivo de velar por el empleo de vacunas de un modo seguro y eficaz en el mundo y de asegurar que las políticas y las recomendaciones sobre inmunización son las mejores, utiliza los mejores datos disponibles, revisa, recopila y publica con regularidad información referente a la seguridad de todas las vacunas a través de su Comité Asesor Global sobre Seguridad de las Vacunas (GACVS). El Comité Consultivo Mundial sobre Inocuidad de las Vacunas (GACVS) propone unas condiciones necesarias para que un evento adverso pueda ser atribuido a la vacunación. Cuando se evalúa un evento adverso se deben tener en cuenta una serie de premisas para poder establecer el mayor grado de evidencia en la relación con el producto vacunal. Estas premisas o puntos clave están recogidos en un manual disponible para su consulta en red, que sirve de guía para la evaluación de la causalidad global a través de un proceso sistemático y estandarizado y se encuentran resumidos en la tabla 3.3.
Tabla 3.3. Puntos clave para la evaluación de la causalidad de un evento adverso relacionado con vacunas. (OMS*)
| Puntos clave para la evaluación de la causalidad de un evento adverso relacionado con vacunas |
| 1. Consistencia de resultados (coherencia). La asociación entre un posible evento adverso y la administración de una vacuna debe ser constante, es decir que los resultados deben ser reproducibles en distintos lugares, y puede obtenerse por distintos investigadores. Diferentes métodos de investigación conducen a las mismas conclusiones. |
| 2. Fuerza de la asociación. La asociación debe ser fuerte en magnitud (en el sentido epidemiológico), del mismo modo que la relación dosis-respuesta de la vacuna con los efectos adversos. |
| 3. Especificidad. La asociación debe tener un carácter diferencial; el evento adverso debe estar vinculado de forma única o específica a la vacuna en cuestión y no presentarse, con frecuencia, en combinación con otros estímulos o condiciones externas. |
| 4. Relación temporal. Debe haber una clara relación temporal entre la administración de la vacuna y el acontecimiento adverso, en el cual la recepción de la vacuna debe preceder a las primeras manifestaciones del evento o a la clara exacerbación de una condición existente. Por ejemplo, una reacción anafiláctica segundos o minutos después de la inmunización sería fuertemente sugestiva de causalidad. Tras una semana de la vacunación sería una prueba menos plausible de relación causal. |
| 5. Plausibilidad biológica. La asociación debe ser coherente, es decir, biológicamente plausible y explicable de acuerdo a los hechos conocidos en la historia natural y biológica de la enfermedad. |
* Modificado de Causality assessment of an adverse event following immunization (AEFI): user manual for the revised WHO classification(Second edition) 2018
Existen otras instituciones independientes que trabajan y revisan exhaustivamente los datos de seguridad, muy especialmente la Brighton Collaboration que ha desarrollado un grupo de trabajo multidisciplinar internacional que, en concordancia con la OMS, los CDC y el European Centre for Disease Prevention and Control (ECDC), ha establecido definiciones estandarizadas de los efectos adversos tras la administración de vacunas. Esta clasificación permite compartir y comparar datos de seguridad de las vacunas de diferentes procedencias geográficas entre los profesionales de todo el mundo. La lista completa de las definiciones de la Brighton Collaboration está disponible en su página web, previo registro, o en otras fuentes, y su empleo está recomendado por las organizaciones especialmente implicadas en la evaluación de la seguridad de las vacunas como la OMS, la FDA y la EMA.
5. Problemas específicos relacionados con la seguridad de las vacunas
La coincidencia temporal de la aparición de eventos adversos con la administración de las vacunas ha hecho que a lo largo de los años se hayan comunicado reacciones o eventos coincidentes. Estudios exhaustivos no han encontrado, en la mayoría de los casos, una relación de causalidad que demostrara que ese efecto adverso estuviera realmente relacionado con la vacuna. A continuación, se muestran diferentes eventos adversos en los que, tras su investigación, no se ha encontrado relación causal con estos fármacos.
Tiomersal y neurotoxicidad
Un estudio realizado por el IOM (Instituto de Medicina), organismo independiente que representa el ámbito sanitario en la Academia Nacional de Ciencias de EE. UU., planteó la hipótesis de que el tiomersal podía producir efectos neurotóxicos, especialmente en prematuros. A pesar de no poder demostrarse esta suposición, en 1999, la FDA recomendó a los fabricantes de vacunas que adoptaran modificaciones en el proceso de producción de las mismas, con el objetivo de reducir la cantidad de tiomersal y si fuera posible sustituirlo.
Desde el año 2002, con la excepción de algunas vacunas antigripales en sus presentaciones multidosis, las vacunas infantiles comercializadas en Europa y EE. UU. carecen de tiomersal en su composición.
Una revisión completa realizada por el IOM en 2004 no halló ninguna evidencia que respalde la asociación entre el tiomersal contenido en las vacunas y la neurotoxicidad y, concretamente, su relación con el autismo. Posteriormente, en el año 2011, corroboró en una nueva actualización de su documento de seguridad la ausencia de relación entre tiomersal y autismo.
Triple vírica y autismo
Ha sido, y es, una de las cuestiones con mayor impacto en la opinión pública con relación a la posible neurotoxicidad de las vacunas, que fue suscitada por el fraudulento estudio original de Wakefield y cols. en el Reino Unido y publicado en The Lancet en 1998, en el que se estableció la hipótesis que vinculaba la vacuna triple vírica con el desarrollo del autismo.
Numerosos estudios controlados y revisiones de expertos en todo el mundo no han encontrado ninguna evidencia de tal asociación ni datos que apoyen la plausibilidad biológica de dicha relación causa-efecto. En febrero de 2010 el comité editorial de The Lancet se retractaba de la publicación del trabajo de Wakefield, tras comprobar la falsedad de la información de dicho estudio.
En enero de 2011, la revista British Medical Journal (BMJ) publica una serie de reportajes que demuestran que Wakefield manipuló los datos, falseó información y realizó un uso fraudulento de su estudio.
Un metanálisis publicado en 2014, realizó una revisión extensa de toda la literatura, incluyendo cinco estudios de cohortes con 1 256 407 niños y cinco estudios de casos y controles que incluyeron a 9920 niños. Los datos de los estudios revisados no revelaron relación entre vacunación y autismo. Además, no encontraron evidencia entre los componentes de las vacunas (tiomersal o mercurio) o la vacuna triple vírica (TV) con el desarrollo del autismo o el trastorno del espectro autista.
Vacunas frente al rotavirus e invaginación intestinal
La primera vacuna frente al rotavirus se comercializó en EE. UU. por Wyeth-Lederle Vaccines en 1998, con el nombre de RotaShield. Se incluyó en el calendario de vacunaciones sistemáticas en EE. UU. en 1999. El sistema de notificación de efectos adversos de las vacunas VAERS detectó, en tan solo 4 meses, un evento adverso de dicha vacuna en la que se observaba una posible asociación entre la misma y casos de invaginación intestinal. La evaluación combinada mediante el sistema de bases de datos vinculadas sobre seguridad confirmó un riesgo estadísticamente significativo de invaginación intestinal en los 7 días tras la administración de la primera dosis con un riesgo atribuible de un caso adicional de invaginación por cada 10 000 vacunados.
Esta experiencia estableció un nuevo estándar en la amplitud de las pruebas de seguridad que las nuevas vacunas frente al rotavirus deberían superar. El tamaño muestral de los diferentes estudios de seguridad requería un número superior a 70.000 lactantes para demostrar la ausencia de asociación con las nuevas vacunas desarrolladas, convirtiéndolos en el paradigma de seguridad vacunal de los ensayos clínicos.
Estos estudios se realizaron con las dos vacunas
disponibles actualmente, la vacuna recombinante pentavalente
bovina-humana RotaTeq (MSD) y la vacuna monovalente humana Rotarix
(GlaxoSmithKline), comprobando la ausencia de su posible asociación con
la invaginación intestinal.
Datos comunicados de farmacovigilancia activa en Australia tras dos años
de vacunación, no constataron un incremento global de invaginación
intestinal en las cohortes vacunadas, aunque detectaron un posible mayor
riesgo de casos en los 21 días siguientes a la primera dosis con ambas
vacunas. En México se observó también una tasa de casos de invaginación
más alta a la esperada en los 7 días posteriores a la dosis con la
vacuna monovalente.
En EE. UU., país en que la vacunación es sistemática y se utilizan ambas vacunas, no se detectó un incremento de casos de invaginación intestinal, con más de 30 millones de dosis distribuidas de RotaTeq y cerca de 3 millones de dosis de Rotarix. Los CDC concluyeron que con los estudios de seguimiento en EE. UU. no es posible excluir un nivel tan bajo de riesgo como el detectado en México, estimando que si este riesgo existiera representaría a lo sumo un caso por 100 000 vacunados, siendo el beneficio/riesgo claramente favorable para la vacunación. Actualmente se considera que este riesgo se cifra en 1 a 5 casos por 100 000 vacunados, sobre todo en los 7 días siguientes tras la primera dosis.
Vacunas frente al rotavirus y presencia de circovirus porcino
En febrero de 2010, un grupo de investigadores detectó, con la aplicación de nuevas técnicas de gran sensibilidad, la presencia de material genético (ADN) de circovirus porcino tipo 1 (PCV1) en la vacuna Rotarix, y en mayo de 2010 se comprobó también la presencia de material genético de PCV1 y de circovirus porcino tipo 2 (PCV2) en la vacuna RotaTeq. Los circovirus son pequeños virus ADN que infectan a animales y no son infecciosos en seres humanos.
Después de una extensa evaluación, los comités de expertos de la FDA de EE. UU., y la EMA concluyeron de forma unánime que tanto la presencia de una pequeña cantidad de partículas del virus PCV-1 en la vacuna Rotarix como de fragmentos de ADN de virus PCV-2 en la vacuna RotaTeq no afectaba a la seguridad ni a la eficacia de estas vacunas, no representaban un problema para la salud humana y establecieron que no existía ninguna razón para limitar el uso de las mismas. No obstante, ambas compañías establecieron de inmediato nuevos planes de fabricación para garantizar la producción de vacunas libres de circovirus, y en la actualidad, ambas vacunas ya no contienen partículas del virus PCV en su composición.
Vacunas frente al papilomavirus humano y afectación neurológica
En España, en febrero de 2009, se comunicaron dos casos de adolescentes afectadas por convulsiones no sincopales relacionadas temporalmente con la administración de Gardasil. Después de un análisis específico de los casos y de todos los datos de seguridad en Europa con más de 3 millones de dosis administradas no se pudo establecer ninguna evidencia de relación causal de estos casos con la vacuna. La EMA, el 19 de febrero de 2009, concluyó su investigación confirmando que la vacunación frente al papilomavirus presenta un buen perfil de seguridad con un beneficio claramente superior al riesgo, recomendando mantener dicha vacunación en Europa con ambas vacunas y con las mismas indicaciones.
La OMS, en junio de 2009, revisó todos los datos mundiales de seguridad de las vacunas frente al papilomavirus, en concreto tras más de 60 millones de dosis de vacuna tetravalente administradas en 21 países. El GACVS se reafirmó en el adecuado perfil de seguridad de esta vacuna y corroboró que el efecto adverso más frecuente de ésta es su reactogenicidad local y el dolor muscular. Se comunicaron algunas reacciones alérgicas en pacientes sensibilizados a alguno de los componentes y se constató un incremento de declaraciones de síncopes tras la administración de vacunas en adolescentes y jóvenes, que se consideran debidas a una reacción vagal más frecuente en este grupo de edad relacionada con la administración por inyección intramuscular. Este hecho se ratificó, de nuevo, el 12 de marzo de 2014 por el Global Advisory Committee on Vaccine Safety de la OMS.
Un estudio local en EE. UU., en el que se siguió de forma prospectiva, durante 6 meses, a más de 189 000 mujeres de entre 9 y 26 años, vacunadas con la vacuna VPH-4, no observó ningún tipo de asociación con la aparición de las 18 principales enfermedades autoinmunitarias, incluyendo las de tipo neurológico y reumatoide.
Un estudio realizado en Dinamarca y Suecia, con más de 780 000 niñas y mujeres de entre 10 y 44 años, inmunizadas con VPH-4, demostró la ausencia de asociación entre el empleo de esta vacuna y el desarrollo de esclerosis múltiple u otras enfermedades desmielinizantes.
En Julio de 2017, la OMS, a través del GACVS, afirmó de manera contundente la extremada seguridad de las vacunas frente al papiloma humano. Desde la comercialización de estas vacunas en 2006, se han distribuido más de 270 millones de dosis a nivel mundial. El GACVS ha revisado los datos de seguridad en 2007, y posteriormente en 2008, 2009, 2013, 2014 y 2015. El riesgo de anafilaxia se ha estimado aproximadamente en 1,7 casos por millón de dosis, y el síncope relacionado se ha identificado como una reacción de ansiedad o estrés relacionada con la inyección. No se han identificado otras reacciones adversas relacionadas con las vacunas. El Comité sigue expresando preocupación por el hecho de que los eventos adversos no confirmados tengan un impacto negativo demostrable en la cobertura de la vacuna en un número creciente de países, y que esto genere un verdadero daño en la población que puede beneficiarse de la protección demostrada por las mismas.
Vacunas frente a la gripe pandémica H1N1 2009
Desde el inicio de la pandemia, la OMS coordinó de forma continuada el intercambio de información sobre la seguridad de las vacunas utilizadas con las autoridades sanitarias de la mayoría de los países. El GACVS de la OMS revisó en junio de 2010 los datos de seguridad de las nuevas vacunas pandémicas frente al virus de la gripe A H1N1 2009 tras su utilización a escala mundial. Además, de forma especial, se realizó una vigilancia activa de la posible asociación con el síndrome de Guillain-Barré y la seguridad en grupos de población específicos como son las mujeres embarazadas y los pacientes inmunodeprimidos.
Se han evaluado los datos de seguridad tras la administración de vacunas inactivadas no adyuvadas, adyuvadas con MF59 y AS03 y atenuadas a más de 200 millones de personas a nivel mundial. Los resultados muestran un incremento del riesgo de síndrome de Guillain-Barré, observándose aproximadamente un caso por 1 000 000 de dosis, similar al observado con vacunas antigripales estacionales trivalentes inactivadas no adyuvadas, que hacen que, teniendo en cuenta que la infección por el virus salvaje también se correlaciona con la aparición de casos de Guillain-Barré, el beneficio/riesgo de la vacunación antigripal sea claramente favorable.
No se produjeron reacciones adversas inesperadas y los datos de seguridad en la administración a mujeres embarazadas fueron muy tranquilizadores.
En algunos países nórdicos, concretamente en Finlandia, Suecia e Islandia, se dio a conocer un incremento de casos de narcolepsia relacionados con la administración de Pandemrix, vacuna adyuvada con AS03. La EMA comunicó en febrero de 2011 que la evidencia científica disponible era insuficiente para establecer una relación causal entre esta vacuna y los casos observados. En 2013 dice que los informes procedentes de Suecia, Francia y Finlandia coinciden en que los adultos jóvenes tienen un aumento del riesgo de narcolepsia después de la vacunación con Pandemrix y reitera la urgencia de continuar la investigación para identificar los mecanismos biológicos subyacentes de esta asociación. Lo mismo se apreció en Irlanda y Reino Unido, por lo que se concluyó que, en personas con predisposición, la vacuna podría ocasionar narcolepsia.
La conclusión principal del GACVS es que las vacunas pandémicas han presentado un adecuado perfil de seguridad.
Adyuvantes de nueva generación
Las vacunas frente a la gripe estacional denominadas Fluad/Chiromas (Novartis) y Dotaricin (Alentia BIotech) están adyuvadas con MF59 (emulsión de aceite en agua), también utilizado en alguna de las vacunas frente a la gripe pandémica. En un metaanálisis que evaluó 64 ensayos clínicos con más de 20 000 adultos vacunados con vacunas antigripales estacionales adyuvadas con MF59, se observó que estas presentan una mayor tasa de reacciones locales y sistémicas que las vacunas no adyuvadas en los 3 días siguientes a la administración de la vacuna. No se observó ningún incremento de enfermedades autoinmunes asociadas, ni se relacionó con acontecimientos adversos graves, por lo que se consideró que presentaban un buen perfil de seguridad. Se comunicaron los resultados de ensayos clínicos con esta vacuna en niños a partir de los 6 meses de edad con un buen perfil de seguridad.
El AS04 es un sistema adyuvante que combina sales de aluminio con MPL (3-O-desa-cil-4'-monofosforil lípido A). Se ha utilizado en la vacuna frente a la hepatitis B Fendrix (GlaxoSmithKline), en la vacuna frente al papilomavirus Cervarix (GlaxoSmithKline) y en una vacuna que no se comercializó frente al herpes simple tipo II. En un análisis integrado que agrupa los ensayos clínicos de estas vacunas que contienen AS04 y que incluyeron a más de 68 000 personas, no se detectó ningún incremento significativo en el grupo vacunado de la incidencia de enfermedades autoinmunes en un periodo de seguimiento medio de 2 años. Los datos de monitorización poscomercialización de Cervarix, en los países que la utilizan de forma sistemática y tras la distribución de más de 16 millones de dosis, no detectaron problemas de seguridad con esta vacuna ni un incremento de enfermedades autoinmunes.
Efectos adversos relacionados con la administración
Es muy importante evitar los efectos adversos relacionados con la administración de las vacunas. Para ello es imprescindible que el personal sanitario dedicado a la vacunación tenga un adecuado conocimiento de las técnicas de administración y esté familiarizado con los preparados vacunales utilizados. Esto es esencial para evitar errores, fácilmente prevenibles, que pueden comprometer seriamente la seguridad de la vacunación.
La vacunación, especialmente en adolescentes y adultos jóvenes, puede asociarse a síncope vasovagal, una pérdida de conciencia transitoria y del tono postural debidos a un reflejo simpático anormal, con recuperación espontánea. Según datos del VAERS, este fenómeno puede producirse en el curso de las 12 horas tras la administración de una vacuna. En el 45 % de los casos los pacientes tienen edades entre los 10 y los 19 años y en el 57 % son del sexo femenino.
Se recomienda un período de vigilancia tras la administración de vacunas de 15-30 minutos, para la atención inmediata del paciente tras posibles efectos adversos.
6. Contraindicaciones y precauciones de las vacunas
En la actualidad existen muy pocas contraindicaciones de las vacunas y es fundamental conocerlas por parte de todos los profesionales. Es muy importante diferenciar claramente entre contraindicaciones y precauciones, ya que las falsas contraindicaciones suponen una oportunidad de vacunación perdida e incrementan el riesgo de disminuir las coberturas vacunales.
Además, la contraindicación en la mayoría de las ocasiones está basada en la estimación del beneficio/riesgo. Por ejemplo, cuando el beneficio previsible para el sujeto que va a recibir la vacuna es menor que el riesgo de padecer la enfermedad, o cuando por la edad o por el estado del paciente se prevea una escasa respuesta inmunológica.
Las precauciones y contraindicaciones, definidas en la ficha técnica de cada vacuna, pueden cambiar con el tiempo, por lo que deben revisarse las fichas actualizadas.
El profesional que administra vacunas es responsable de conocer tanto las contraindicaciones como las precauciones vigentes en el país en el que ejerce.
Antes de vacunar se comprobará si el paciente tiene contraindicaciones temporales o permanentes para ser vacunado.
Contraindicaciones verdaderas de vacunación
Es una condición del individuo que aumenta de forma importante el riesgo de padecer un efecto adverso grave si se le administra una vacuna concreta.
Solo dos situaciones se consideran contraindicaciones permanentes y nunca podrá administrarse la vacuna.
La mayoría de las contraindicaciones son temporales y una vez pasada esa situación el paciente podrá ser vacunado.
Contraindicaciones permanentes
- Una reacción alérgica anafiláctica a una dosis previa de una vacuna o a algún componente de la misma, es una contraindicación permanente para volver a administrar dicha vacuna o cualquier otra vacuna que contenga ese componente.
- -Antecedente de encefalopatía o encefalitis en los 7 días posteriores a la recepción de una dosis de cualquier vacuna con un componente antipertúsico, no atribuibles a otra causa, de las que el niño no se hubiera recuperado completamente en una semana. Si lo hizo, o se identificó otra causa, no se debe interrumpir ni demorar la aplicación de la pauta de vacunación frente a la tosferina correspondiente a su edad. La vacuna Td también está autorizada en menores de 7 años cuando haya contraindicación para la vacuna de la tosferina.
Contraindicaciones temporales
El embarazo y la inmunodepresión o inmunosupresión son los dos ejemplos más comunes de contraindicación temporal, únicamente para las vacunas víricas o bacterianas atenuadas.
Las contraindicaciones temporales permiten la administración de una vacuna una vez se modifique la situación del sujeto, y son las siguientes:.
- Embarazo. El embarazo es una situación que contraindica de forma temporal la administración de cualquier vacuna atenuada ya sea vírica o bacteriana. Los registros de mujeres vacunadas inadvertidamente durante el embarazo con triple vírica o varicela demuestran que no se han producido casos de síndrome de rubeola congénita ni de varicela congénita, por lo que la administración inadvertida de estas vacunas durante el embarazo no constituye un motivo de interrupción del embarazo; además el riesgo en todo caso es mucho menor que el de la infección natural durante el embarazo. Por otro lado las vacunas inactivadas se pueden (y algunas se deben) administrar en el embarazo; como ejemplo la vacuna de la gripe en cualquier trimestre del embarazo y la vacuna de la tosferina (Tdpa) entre la 27 y 36 semanas de gestación.
- Inmunodepresión. La inmunodepresión o el tratamiento inmunosupresor contraindican, con algunas excepciones, las vacunas atenuadas; los niños con niveles de linfocitos CD4+ superiores al 15 % pueden recibir la vacuna triple vírica y la de la varicela. Esta inmunodepresión puede condicionar una respuesta inadecuada de las vacunas inactivadas, que se podrán administrar, aunque posteriormente es posible que precisen dosis adicionales. En nuestro país los niños sanos que conviven con personas inmunodeprimidas pueden y deben recibir todas las vacunas de calendario que les correspondan por su edad, incluidas las de virus vivos como triple vírica (sarampión, rubeola o parotiditis), varicela y rotavirus, asimismo deben vacunarse anualmente frente a la gripe si tienen, al menos, 6 meses de edad.
- Cualquier enfermedad moderada o grave (crisis asmática, cardiopatía descompensada, diarrea aguda...), con o sin fiebre, es una contraindicación temporal para la administración de las vacunas, salvo situación de riesgo epidémico muy elevado. Una vez desparecida la situación podrán recibir vacunas.
- La edad de administración puede considerarse una contraindicación. La vacuna triple vírica no se aconseja administrarla antes de los 12 meses de vida porque puede interferir con los anticuerpos maternos y no producir una respuesta inmunológica completa, aunque en situaciones epidémicas se puede administrar a partir de los 6 meses de edad, aunque posteriormente deberá recibir dos dosis a partir de que cumpla los 12 meses de edad. Igualmente, la vacuna frente a la hepatitis A se administra a partir de los 12 meses de edad, la antigripal a partir de los 6 meses de edad y los componentes de carga antigénica estándar de difteria y tosferina (D y P) solo se pueden aplicar hasta los 7 años de edad.
Precauciones o limitaciones para la vacunación
Son situaciones en las que la administración de una vacuna condiciona un mayor riesgo de presentar un efecto adverso o bien que la respuesta inmunitaria a la vacuna pueda ser insuficiente y no permita obtener una adecuada protección.
Una precaución indica que debe valorarse el cociente riesgo/beneficio antes de decidir la administración de la vacuna en cuestión. En determinadas circunstancias en las que el beneficio es superior al riesgo (p. e. situación de epidemia), la vacuna puede administrarse.
Algunas situaciones consideradas precauciones son:
- Encefalopatía progresiva, epilepsia refractaria
al tratamiento farmacológico u otro trastorno neurológico no
estacionario de causa desconocida En estos casos se recomienda retrasar
la vacunación frente a la tosferina hasta la estabilización del proceso.
Si a juicio del médico responsable no es esperable una evolución hacia
su estabilización en un período de tiempo razonable, dada la ausencia de
evidencias que apoyen la relación entre la vacuna de la tosferina
acelular y la generación de un daño neurológico añadido, debería
plantearse la opción de vacunar con preparados que contengan antígenos
de B. pertussis, por presentar un balance riesgo/beneficio favorable.
En este sentido, ante encefalopatías epilépticas inestables del lactante no vinculadas patológicamente a la vacunación, como los síndromes de West y de Dravet, debe abogarse por no interrumpir ni demorar la recepción de las vacunas acelulares de la tosferina de acuerdo con sus indicaciones sistemáticas.. - Historia de síndrome de Guillain-Barré en las 6 semanas posteriores a la administración de una vacuna. En este caso deberá valorarse con precaución la conveniencia o no de administrar una dosis posterior de dicha vacuna.
- Historia de reacciones de hipersensibilidad de tipo Arthus después de una dosis previa de una vacuna que contiene toxoide diftérico o toxoide tetánico. En este caso se debe postergar la vacunación hasta que hayan transcurrido, al menos, 10 años desde la última dosis de vacuna que contenga estos toxoides.
- Pacientes con enfermedades crónicas y/o inmunodepresión: la respuesta a la vacunación puede ser subóptima en algunos de estos pacientes, por lo que las vacunas deben administrarse atendiendo a este hecho. Se ha comentado previamente que en caso de inmunodepresión las vacunas atenuadas están contraindicadas en la mayoría de las situaciones.
- La administración de productos biológicos (inmunoglobulinas o sangre) antes de la administración de la vacuna triple vírica o la de la varicela (ver capítulo 43).
- Una excepción a la anafilaxia como contraindicación son los niños con alergia anafiláctica al huevo, ya que pueden recibir la vacuna triple vírica en el centro de salud, porque prácticamente no tiene proteínas de huevo, esperando posteriormente 15-30 minutos en la sala de espera como con todas las vacunas y actualmente, también, pueden recibir vacunas inactivadas frente a la gripe en el centro de salud.
- La cirugía y la anestesia no presentan interacciones e interferencias con las vacunaciones, en general. Aunque en algunas ocasiones es conveniente tener en cuenta ciertas precauciones para alcanzar el máximo beneficio de las vacunaciones (por ejemplo en la esplenectomía programada y el trasplante de órganos), y acomodar las agendas de la intervención y las vacunaciones para evitar la coincidencia de la posible reacción vacunal con la hospitalización y la intervención. Aparte de las circunstancias especiales citadas, en los casos en los que estén indicadas una intervención quirúrgica o diagnóstica con anestesia y alguna vacunación, se pueden programar de la siguiente forma:
- Vacunaciones antes: 5-7 días antes en el caso de vacunas inactivadas y 14 días en el de las atenuadas.
- Vacunaciones después: 1-2 semanas, según la recuperación clínica del paciente.
7. Falsas contraindicaciones
Es muy importante conocer cuáles son las falsas contraindicaciones de las vacunas, para evitar oportunidades perdidas; porque no solamente conllevan retrasos innecesarios para la adecuada protección, sino que además favorecen la propagación en la sociedad de creencias erróneas con relación a las situaciones en las que se puede o no se puede vacunar.
Existe una larga lista de circunstancias consideradas contraindicaciones sin serlo. Entre las más frecuentes destacan las mostradas en la tabla 3.4.
Tabla 3.4.- Falsas contraindicaciones y precauciones frente a las vacunas.
|
Vacuna |
Circunstancias habitualmente percibidas de forma errónea como contraindicación o precaución |
|
En general, para todas las vacunas, |
- Enfermedad aguda leve, con o sin fiebre |
|
DTPa |
- Historia de fiebre de ≥40,5 °C durante <48 horas después de la vacunación con una dosis previa de DTP/DTPa/Tdpa |
|
Gripe atenuada |
- Profesionales sanitarios que atienden a pacientes con enfermedades
crónicas o inmunodeprimidos (una excepción son los que atienden a
pacientes con inmunodepresión grave que requieren atención en un entorno
protegido) |
|
Gripe inactivada |
- Alergia no grave (p. ej., por contacto) al látex o al tiomersal |
|
Hepatitis B |
- Embarazo |
|
Neumococo polisacarídica (VNP23) |
- Historia de enfermedad neumocócica invasora o neumonía |
|
Polio inactivada |
- Administración previa de ≥1 dosis de vacuna atenuada oral frente a la polio |
|
Rotavirus |
- Prematuridad |
|
SRP (triple vírica) |
- Prueba cutánea de la tuberculina positiva |
|
Tdpa |
- Historia de fiebre de ≥40,5 °C durante <48 horas después de la vacunación con una dosis previa de DTP/DTPa/Tdpa |
|
Varicela |
- Embarazo de la madre del receptor u otro contacto cercano o familiar |
|
Virus Papiloma Humano |
- Prueba previa de Papanicolaou alterada |
Abreviaturas: DTP = toxoide diftérico, toxoide tetánico y tosferina de células enteras; DTPa = toxoides tetánico y diftérico y tosferina acelular de carga estándar; Hib = Haemophilus influenzae tipo b; Men·ACWY = vacuna tetravalente conjugada meningocócica; SRP = sarampión, rubeola y paperas; Td = toxoides tetánico y diftérico de carga reducida; Tdpa = toxoide tetánico, toxoide diftérico reducido y tosferina acelular de carga reducida; VIH = virus de la inmunodeficiencia humana; VNC = vacuna antineumocócica conjugada; VNP23 = vacuna polisacárida neumocócica de 23 serotipos; VPH = virus del papiloma humano; VPI = poliovirus inactivado.
(a)
Los antibióticos podrían interferir con la vacuna tifoidea oral Ty21a y
ciertos medicamentos antivirales pueden interferir con las vacunas que
contienen el componente varicela.
(b) Una excepción es el síndrome de Guillain-Barré
dentro de las 6 semanas siguientes a una dosis de vacuna frente a la
gripe o de vacuna que contiene toxoide tetánico, que son precauciones
para las vacunas frente a la gripe y las vacunas que contienen toxoide
tetánico, respectivamente.
(c) Las vacunas TV y varicela se pueden administrar el
mismo día. Si no se administran el mismo día, estas vacunas deben
separarse por, al menos, 28 días.
(d) Los niños infectados por el VIH deben recibir
inmunoglobulina después de la exposición al sarampión. Los niños
infectados por el VIH pueden recibir la vacuna contra la varicela y el
sarampión si el recuento de linfocitos T CD4+ es >15 %.
(e) La vacunación contra el sarampión podría suprimir
temporalmente la reactividad de la tuberculina. La vacuna que contiene
el sarampión se puede administrar el mismo día que la prueba de la
tuberculina o IGRA. Si las pruebas no pueden realizarse hasta después
del día de la vacunación TV, la prueba debe posponerse durante, al
menos, 4 semanas después de la vacunación. Si existe una necesidad
urgente de realizar una prueba cutánea o IGRA, hágalo con el
entendimiento de que la vacuna puede reducir la reactividad.
(f) Si un vacunado experimenta una erupción
supuestamente relacionada con la vacuna 7-25 días después de la
vacunación, la persona debe evitar el contacto con personas
inmunocomprometidas durante la erupción.
Fuente: Modificado de Advisory Committee on Immunization Practices (ACIP). Contraindications and Precautions. Vaccine Recommendations and Guidelines of the ACIP: General Best Practice Guidelines for Immunization (2018).
8. Bibliografía
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Vacunación de niños en los que no está indicada la vacuna frente a la tosferina. 3 de abril de 2009. Disponible en:
- Andrews N, Stowe J, Miller E. No increased risk of Guillain-Barré syndrome after human papilloma virus vaccine: A self-controlled case-series study in England. Vaccine. 2017;35:1729–32.
- Asturias EJ, Wharton M, Pless R, MacDonald NE, Chen RT, Andrews N, et al. Contributions and challenges for worldwide vaccine safety: The Global Advisory Committee on Vaccine Safety at 15 years. Vaccine. 2016;34:3342-9.
- Canadian Immunization Guide. Part 2. Vaccine Safety and Adverse Events Following Immunization. Public Health Agency of Canada.
- Centers for Disease Control and Prevention. Statement Regarding Rotarix and RotaTeq Rotavirus Vaccines and Intussusception. 2010.
- Centers for Disease Control and Prevention. Epidemiology and Prevention of Vaccine-Preventable Diseases. Atkinson W, Wolfe S, Hamborsky J (eds.). Chapter 2 General Recommendations on Immunization. 13th ed. Washington DC: Public Health Foundation, 2015.
- Centers for Disease Control and Prevention. Chart of Contraindications and Precautions to Commonly Used Vaccines. June 2018.
- Centers for Disease Control and Prevention. Rotavirus Vaccine (RotaShield) and Intussusception.
- Chao C, Klein NP, Velicer CM, Sy LS, Slezak JM, Takhar H, et al. Surveillance of autoimmune conditions following routine use of quadrivalent human papillomavirus vaccine. J Intern Med. 2012;271:193-203.
- Chen RT, Davis RL, Sheeedy KM. Seguridad de las vacunas. En: Plotkin SA, Orenstein WA, Picazo JJ (eds.). Vacunas, 1.ª ed. española. Madrid: Editorial Médica AWWE, S.L.; 2007. p. 1629-55.
- Editors of the Lancet. Retraction-Ileal-lymphoid-nodular hyperplasia, non-specific colitis, and pervasive developmental disorder in children. Lancet. 2010;375(9713):445.
- European Medicines Agency. European Medicines Agency recommends continued vaccination with Gardasil. Doc. Ref. EMEA/CHMP/103339/2009.
- Ezeanolue E, Harriman K, Hunter P, Kroger A, Pellegrini C. General Best Practice Guidelines for Immunization. Best Practices Guidance of the Advisory Committee on Immunization Practices (ACIP). 2020.
- Glass RI, Parashar UD. Rotavirus vaccines-balancing intussusception risks and health benefits. N Engl J Med. 2014;370:568-70.
- Haber P, Sejvar J, Mikaeloff Y, De Stefano F. Vaccines and Guillain-Barré syndrome. Drug Saf. 2009;32:309-23.
- IOM (Institute of Medicine). 2012. Adverse effects of vaccines: Evidence and causality. Washington, DC: The National Academies Press.
- Isai A, Durand J, Le Meur S, Hidalgo-Simon A, Kurz X. Autoinmune disorders after immunization with influenza A H1N1 vaccines with and without adjuvant; Eudravigilance data and literature review. Vaccine. 2012;30:7123-9.
- Loughlin AM, Marchant CD, Adams W, Barnett E, Baxter R, Black S, et al. Causality assessment of adverse events reported to the Vaccine Adverse Event Reporting System (VAERS). Vaccine. 2012;30:7253-9.
- Sarkanen T, Alakuijala A, Julkunen I, Partinen M. Narcolepsy Associated with Pandemrix Vaccine. Curr Neurol Neurosci Rep. 2018;18:43.
- Scheller NM, Svanström H, Pasternak B, Amheim-Dahlström L, Sundström K, Fink K, et al. QuadrivalentHPV vaccination and risk of multiple sclerosis and other demyelinating diseases of the Central Nervous System. JAMA. 2015;313:54-61.
- Stowe J, Andrews N, Kosky C, Dennis G, Eriksson S, Hall A, et al. Risk of Narcolepsy after AS03 Adjuvanted Pandemic A/H1N1 2009 Influenza Vaccine in Adults: A Case-Coverage Study in England. Sleep. 2016;39:1051-7.
- Taylor LE, Swerdfeger AL, Eslick GD. Vaccines are not associated with autism: an evidence-based meta-analysis of case-control and cohort studies. Vaccine. 2014;32:3623-9.
- Thompson WW, Price C, Goodson B, Shay DK, Benson P, Hinrichsen VL, et al. Vaccine Safety Datalink Team. Early thimerosal exposure and neuropsychological outcomes at 7 to 10 years. N Engl J Med. 2007;357:1281-92.
- Verstraeten T, Descamps D, David MP, Zahaf T, Hardt K, Izurieta P, et al. Analysis of adverse events of potential autoimmune aetiology in a large integrated safety database of AS04 adjuvanted vaccines. Vaccine. 2008;26:6630-8.
- World Health Organization. Causality assessment of an adverse event following immunization (AEFI): user manual for the revised WHO classification (second edition) Geneva: World Health Organization; 2018.
- World Health Organization: Global Advisory Committee on Vaccine Safety, report of meeting held 16-17 june 2010. Wkly Epidemiol Rec. 2010;85:285-92.
- World Health Organization: Global Advisory Committee on Vaccine Safety, report of meeting held 12-13 June 2013. Wkly Epidemiol Rec. 2013;88:301-12.
- World Health Organization. Human papillomavirus vaccines: WHO position paper, October 2014. Wkly Epidemiol Rec. 2014;89:465-91.
- World Health Organization. Meeting of the Global Advisory Committee on Vaccine Safety, 7–8 June 2017. Wkly Epidemiol Rec. 2017;92:393-402.
- World Health Organization. WHO E-learning course on Vaccine Safety Basics.
En la Unión Europea, la Agencia Europea de Medicamentos supervisa la regulación de vacunas y otras medicinas, y un comité de la Organización Mundial de la Salud hace recomendaciones para los productos biológicos utilizados a nivel internacional; muchos países han adoptado las normas de la OMS.
Etapas en el desarrollo y las pruebas de vacunas
En Estados Unidos, el desarrollo y las pruebas de las vacunas siguen un conjunto estandarizado de pasos. Las primeras etapas son de naturaleza exploratoria. La regulación y la supervisión aumentan en lo que la vacuna candidata avanza en el proceso.
Primeros pasos: Estudios de laboratorio y en animales
Fase I de los ensayos con la vacuna
Fase II de los ensayos con la vacuna
Un grupo más grande de varios cientos de personas participa en las pruebas de fase II. Algunas de las personas pueden pertenecer a grupos en riesgo de contraer la enfermedad; los ensayos son aleatorios y bien controlados, e incluyen a un grupo de placebo.
Las metas de las pruebas de fase II son estudiar la vacuna candidata en cuanto a su seguridad, capacidad imunógena, dosis propuestas, programa de vacunación y método de aplicación.
Fase III de los ensayos con la vacuna
Las vacunas candidatas que tienen éxito en la fase II avanzan a ensayos más grandes, que involucran de miles a decenas de miles de personas. Las pruebas de fase III son aleatorias y doble ciego, e involucran la vacuna experimental que se prueba contra un placebo (el placebo puede ser una solución salina, una vacuna para otra enfermedad o alguna otra sustancia).
Una meta de la fase III es evaluar la seguridad de la vacuna en un grupo grande de personas. Algunos efectos secundarios poco usuales podrían no ser evidentes en grupos más pequeños de personas que formaron parte de las fases anteriores; por ejemplo, suponga que un suceso adverso, relacionado con una vacuna candidata, pudiera ocurrir en 1 de cada 10,000 personas, para detectar una diferencia significativa de un suceso de baja frecuencia, el ensayo tendría que haber incluido 60,000 sujetos, la mitad de ellos en el control, o en el grupo sin vacuna (Plotkin SA et al. Vaccines, 5th ed. Philadelphia: Saunders, 2008).
La eficacia de la vacuna también se prueba, lo cual puede incluir los siguientes factores: 1) ¿La vacuna candidata previene la enfermedad? 2) ¿Previene la infección por el patógeno? 3) ¿Conduce a la producción de anticuerpos u otros tipos de respuestas inmunológicas relacionadas con el patógeno?
Siguientes pasos: Aprobación y autorización oficial
Después de que un ensayo de fase III resulta exitoso, el creador de la vacuna enviará a la FDA una solicitud de autorización oficial para productos biológicos. Posteriormente, la FDA inspeccionará la fábrica donde se producirá la vacuna y aprobará el etiquetado de la misma.
Después de emitir la autorización oficial, la FDA vigilará la producción de la vacuna, incluyendo las instalaciones de inspección, y revisará las pruebas que hace el fabricante a lotes de vacunas en cuanto a capacidad para obtener el efecto deseado, seguridad y pureza. La FDA tiene el derecho de realizar sus propias pruebas a las vacunas de los fabricantes.
Vigilancia posterior una vez emitida la autorización oficial
Diversos sistemas vigilan las vacunas después de haber sido aprobadas. Entre ellos se incluyen los ensayos de la fase IV, el Sistema de Información sobre Eventos Adversos a una Vacuna (Vaccine Adverse Event Reporting System) y el Enlace de Datos sobre la Seguridad de las Vacunas (Vaccine Safety Datalink).
Fase IV de los ensayos
Los ensayos de la fase IV son estudios opcionales que pueden realizar las compañías de medicamentos después de que se lanza una vacuna. El fabricante puede seguir realizando pruebas a la vacuna en cuanto a seguridad, eficacia y otros posibles usos.
VAERS
En 1990, los CDC y la FDA establecieron el Sistema de Información sobre Eventos Adversos a una Vacuna (VAERS, por sus siglas en inglés). El objetivo de VAERS, de acuerdo con los CDC, es “detectar posibles señales de reacciones adversas relacionadas con las vacunas” (en este caso, una señal es una prueba que indique una posible reacción adversa observable a través de los datos recopilados). Cada año se notifican aproximadamente 30,000 sucesos a VAERS. Entre un 10 y un 15% de estas notificaciones describen reacciones médicas graves que terminan en: hospitalización, enfermedades que ponen en peligro la vida, discapacidad o muerte.
VAERS es un sistema de notificación voluntaria, cualquier padre, proveedor de cuidado médico o amigo del paciente que sospeche una relación existente entre una vacuna y una reacción adversa, puede hace una notificación a VAERS. Posteriormente, los CDC investigan el suceso y tratan de descubrir si la reacción adversa fue realmente ocasionada por la vacuna.
Los CDC declaran que dan seguimiento a los datos del VAERS para:
- Detectar reacciones adversas que sean nuevas, inusuales o raras
- Vigilar el aumento en reacciones adversas conocidas
- Identificar posibles factores de riesgo para el paciente en tipos particulares de reacciones adversas
- Identificar lotes de vacunas cuando aumenten las cifras o los tipos de reacciones adversas notificadas
- Evaluar la seguridad de vacunas cuya autorización oficial se otorgó recientemente
No todas las posibles reacciones adversas notificadas a VAERS son provocadas por una vacuna; los dos incidentes podrían estar relacionados únicamente por el tiempo, y es probable que no todas las reacciones adversas que sean resultado de una vacuna se informen a VAERS. Los CDC declaran que muchas reacciones adversas, como la inflamación en el sitio de la inyección, no se notifican. De acuerdo con los CDC, las reacciones adversas graves “probablemente tienen más probabilidades de notificarse que las leves, en especial cuando ocurren poco después de la vacunación, aunque tal vez sean coincidencias y se relacionen con otras causas”.
VAERS ha identificado con éxito diversas reacciones adversas raras relacionadas con la vacunación. Entre ellas se encuentran:
- Un problema intestinal después de que se introdujo la primera vacuna para el rotavirus en 1999
- Enfermedades neurológicas y gastrointestinales relacionadas con la vacuna contra la fiebre amarilla
Además, de acuerdo con Plotkin et al., VAERS identificó la necesidad de investigar más a fondo la relación de la MMR con un trastorno de coagulación de la sangre, encefalopatía después de la MMR, y un síncope después de la vacunación (Plotkin SA et al. Vaccines, 5th ed. Philadelphia: Saunders, 2008).
Enlace de Datos sobre la Seguridad de las Vacunas
En 1990, los CDC establecieron este sistema, el Enlace de Datos (VSD, por sus siglas en inglés) es una recopilación de bases de datos enlazadas que contienen información de grupos médicos grandes. Las bases de datos enlazadas permiten que los funcionarios recopilen datos sobre vacunación entre las poblaciones que atendieron los grupos médicos. Los investigadores pueden tener acceso a los datos si proponen estudios a los CDC, y estos otorgan la aprobación.
El VSD presenta algunas dificultades; por ejemplo, la base de datos incluye a pocos niños sin vacunar; los grupos médicos que suministran información al VSD podrían tener poblaciones de pacientes que no representen a poblaciones grandes en general; además, los datos no provienen de ensayos aleatorios, controlados y ciegos, sino de la práctica médica real. Por lo tanto, podría ser difícil controlar y evaluar los datos.
El Análisis Rápido de Ciclo (RCA, por sus siglas en inglés) es un programa de VSD que inició en 2005 y vigila datos en tiempo real para comparar tasas de reacciones adversas en personas recién vacunadas con tasas en personas no vacunadas; el sistema se utiliza principalmente para dar seguimiento a nuevas vacunas. Entre las nuevas vacunas que tienen seguimiento en el Análisis Rápido del Ciclo se encuentran la vacuna meningocócica conjugada, la vacuna contra el rotavirus, la vacuna MMRV, la vacuna Tdap y la vacuna HPV. Posteriormente se estudian más a fondo las posibles relaciones entre reacciones adversas y la vacunación.
En conclusión
Las vacunas se desarrollan, prueban y regulan de manera muy similar a otros medicamentos. En general, las vacunas cuentan con pruebas más meticulosas que los medicamentos porque, por lo general, es mayor la cantidad de humanos en los ensayos clínicos de las vacunas. Además, el seguimiento de las vacunas, después de que se otorga la autorización oficial, se examina minuciosamente por los Centros para el Control de Enfermedades (CDC) y la FDA.
Enlaces de interés
- Inyecciones seguras de la OMS
http://www.who.int/infection-prevention/publications/injection-safety/en/ - Global Vaccine Safety (OMS)
http://www.who.int/vaccine_safety/en/ - Vaccine Adverse Event Reporting System, VAERS
https://vaers.hhs.gov/ - Vaccine Safety, (CDC)
https://www.cdc.gov/vaccinesafety/index.html - https://vacunasaep.org/documentos/manual/cap-3
VAX. Understanding vaccine trials: How are AIDS vaccines tested?. IAVI Report. Vol. 1, no. 1. agosto 2003. Acesado el 17 enero 2018.
Plotkin, S.A., Orenstein, W.A., Offit, P.A., eds. Vaccines, 5th ed. Philadelphia: Saunders, 2008. Chapters 3 and 73.
Vaccine Development Table. The Children’s Vaccine Initiative: Achieving the Vision. National Academies Press. Acesado el 17 enero 2018.
U.S. Department of Health and Human Services. Vaccine product approval process. U.S. Food and Drug Administration. Actualizado 09 enero 2018. Acesado el 17 enero 2018.
U.S. Department of Health and Human Services. Investigational New Drug (IND) Application. U.S. Food and Drug Administration. Actualizado 05 octubre 2017. Acesado el 17 enero 2018.
Lilienfeld, D.E. The first pharmacoepidemiologic investigations: national drug safety policy in the United States, 1901-1902. Perspectives in Biology and Medicine. 51.2 (2008): 192-96.
https://articulosclaves.blogspot.com/2021/03/no-es-alarmismo-es-seguir-los.html
- https://www.historyofvaccines.org/index.php/es/contenido/articulos/desarrollo-pruebas-y-reglamentos-para-las-vacunas
- https://www.aemps.gob.es/la-aemps/ultima-informacion-de-la-aemps-acerca-del-covid%E2%80%9119/vacunas-contra-la-covid%E2%80%9119/farmacovigilancia-de-vacunas/
- https://www.aemps.gob.es/medicamentosUsoHumano/vacunas/docs/vigilancia_seguridad_vacunas_COVID-19.pdf?x69995
"Ayer en Galicia no se presentaron a la vacunación un tercio de los llamados. Hay una probabilidad mucho más alta de que alguno de esos no vacunados muera por la Covid que de que alguno de los vacunados tenga algún efecto secundario grave. Pero el daño ya está hecho. El principio de precaución aplicado en este caso no ha hecho sino exacerbar el miedo. Nunca sabremos nada de esos muertos que ayer no se quisieron vacunar, ni de los de mañana o pasado. Los medios no les dedicarán ni un solo titular sensacionalista".Antonio Diéguez
Comunicado Farmacéutica
- https://elpais.com/sociedad/2021-03-18/macron-ordena-el-confinamiento-de-paris-y-otros-15-departamentos.html?utm_source=Facebook&ssm=FB_CM&fbclid=IwAR11o6aZvZgBHFDlF0rNWhyHSvRRE86jBiIihB7IK4767CNzwHCBLS3zZ-s#Echobox=1616096377
- https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov/ciudadania.htm?fbclid=IwAR3Cg9FuTRxvT3uOSQipZpHTkC8ej3Z04g90usKn4m-g6DmskmCHoL0Ozto
- https://www.efesalud.com/autopsia-apunta-vacuna-no-tiene-relacion-muerte-profesora/

No hay comentarios:
Publicar un comentario