Así funcionan las vacunas de ARN mensajero
La COVID-19 está obligando a toda la sociedad a la adaptación a situaciones inusuales y la ciencia no es una excepción. Las vacunas elaboradas a partir de ARN mensajero son un claro ejemplo de ello, pues se han podido elaborar en tiempo récord y ofrecen posibilidades muy prometedoras de cara al futuro. Así es como funcionan.

Las vacunas elaboradas con ARN mensajero presentan dudas por su novedad, pero también oportunidades tremendamente interesantes.
Inicia el año con la primera vacuna contra la COVID-19 aprobada, un modelo desarrollado por Pfizer-BioNtech con la tecnología ARN mensajero (ARNm). El nombre técnico de la vacuna es BNT162b2 y el comercial Comirnaty.
La tecnología de estas vacunas basadas en ARN mensajero monocatenario no es nueva, pues se viene empleando en ensayos preclínicos y clínicos desde hace décadas. Se ha demostrado que producen una potente respuesta protectora en modelos animales contra infecciones por ébola, zika, gripe e incluso bacterias como Streptococcus.
En estos últimos años se han hecho ensayos clínicos en humanos de fase I y II contra el VIH, la gripe, la rabia, el zika, etc. Han sido incluso más numerosos los ensayos clínicos de vacunas ARN contra el cáncer de próstata, el de mama, melanoma, gliobastoma, ovarios, páncreas...
En general, estos resultados sugieren que las vacunas de ARNm son seguras y razonablemente bien toleradas.
La mayor preocupación con este tipo de vacunas, más que su seguridad, ha sido su inestabilidad, su baja eficiencia para introducirlas en las células y que expresen el antígeno. También ha preocupado el hecho de que el ARN puede estimular reacciones inmunológicas de tipo inflamatorio, por lo que todos estos factores han limitado en parte su desarrollo. El ARN es una molécula muy inestable que requiere condiciones de mantenimiento extremas (de menos 80℃), se degrada muy fácilmente por enzimas y no se internaliza de forma eficiente.

Ensayos clínicos con vacunas de ARN mensajero contra enfermedades infecciosas.
Sin embargo, esta tecnología también tiene ventajas y no son pocas. Es relativamente más barata que otro tipo de vacunas y, sobre todo, permite diseñar una vacuna nueva en un tiempo récord. Una vez que se conoce el genoma del patógeno, en unas semanas se pueden producir los primeros prototipos vacunales, lo que la convierte en una excelente herramienta cuando aparece un patógeno nuevo para el que se necesita una vacuna con urgencia, como en una pandemia. En este caso, la rapidez es un beneficio mayor que el problema de su inestabilidad. Moderna fue capaz de diseñar su vacuna de ARNm contra SARS-CoV-2 tan solo seis semanas después de que el genoma del virus se hiciera público.
Además, el proceso de fabricación no requiere emplear sustancias químicas tóxicas, ni cultivos celulares que se pueden contaminar con otros virus o microorganismos, su fabricación es rápida y fácil, requiere poca manipulación con lo que se minimiza el riesgo de posibles contaminantes.
El ARNm no se integra en el ADN, por lo que las vacunas ARNm se consideran potencialmente muy seguras.
Otra ventaja es que el mismo ARN tiene cierto efecto inmunomodulador, por lo que actúan como adyuvante, estimulando de forma inespecífica el sistema inmune. Pero, ¿son realmente eficaces este tipo de vacunas?
Cómo funciona el ARNm dentro de una célula
La información genética se encuentra codificada en el ADN en el núcleo de la célula, en forma de una secuencia de nucleótidos. En el núcleo, el ADN transfiere esa información a la molécula de ARN en un proceso que se denomina transcripción: la secuencia de ADN se copia en forma de ARN.
El ARN sale del núcleo al citoplasma de la célula donde se encuentra con los ribosomas, que son los encargados de traducir esa información codificada en el ARN en una proteína.
Así, la información genética del ADN acaba en una proteína a través del ARN, que actúa como una molécula intermedia, como mensajero, entre ambos. El ARNm no entra en el núcleo celular, tiene una vida media muy corta y es rápidamente degradado. Por eso, para que la síntesis de proteínas continúe, se debe producir ARNm de forma continua.
¿Cómo es una vacuna de ARNm?
La vacuna de ARNm de Pfizer/BioNtech se basa en el genoma del coronavirus, en concreto en el gen que codifica para la proteína S (la glicoproteína de la envoltura del virus que actúa como la llave que se une al receptor de la célula). Pero esa molécula no es un trozo del ARN del virus cualquiera, esa secuencia se ha modificado para aumentar su estabilidad y facilitar que la célula sea capaz de leerla, traducirla y sintetizar la proteína viral.
Como solo se utiliza un fragmento de ARN, este tipo de vacunas no pueden causar la enfermedad
Entre las modificaciones más importantes están:
- La sustitución del nucleósido uridina por el derivado natural metil-pseudouridina. Esta modificación es quizá la más importante, no cambia la información genética (es la misma secuencia), sino la estructura química y hace que la molécula sea mucho menos inmunoreactiva e inflamatoria (menos tóxica).
- Se han optimizado los codones (a cada codón le corresponde un aminoácido) para que sean traducidos más fácilmente por las células humanas.
- Se han protegido los extremos del fragmento del ARN, añadiendo una estructura CAP en el extremo 5´ y una cola de poliadeninas en el extremo 3´, características de todos los ARNm.
- Se han añadido secuencias reguladoras no traducidas (UTR) en ambos extremos.
- Se añade un nuevo codón de terminación y otras secuencias que estabilizan la molécula y facilitan la traducción por la maquinaria de síntesis de proteínas de las células humanas.
- Se ha incluido un par de mutaciones en la secuencia del gen que codifica para la proteína S, que resultan en el cambio de una lisina por una prolina en la posición 986 de la proteína y de una valina por una prolina en la posición 987. De esta forma se produce un cambio en la conformación de la proteína que proporciona una antigenicidad mejor.
Para facilitar que esta molécula sea transportada al interior de las células, va encapsulada en una nanopartícula lipídica que se fusionará con la membrana de la célula. Algunos de los lípidos que forman estas nanopartículas son derivados del polietilenglicol, fosfolípidos, colesterol y otros.
Algunos de estos componente lipídicos son los que pueden causar una reacción alérgica grave en algunas personas, por lo que no está recomendada la vacunación en ellas.
¿Cómo funciona la vacuna de ARNm?
La vacuna se administra por vía intramuscular, donde las nanopartículas lipídicas se fusionan con la membrana de las células musculares y liberan las cadenas de ARNm en el citoplasma. Estas son reconocidas por los ribosomas y por toda la maquinaria enzimática de la célula y sintetizan la proteína S del virus. Es como si a la célula se le hubiera dado el libro de instrucciones (ARNm) para que ella misma sintetizara la proteína del virus.
La proteína vírica se expondrá en la superficie de la célula y estimulará la respuesta inmune. Se producirá así una potente respuesta de anticuerpos neutralizantes que reaccionan contra varias partes de la proteína S (por eso, la aparición de variantes genéticas con mutaciones puntuales en el gen de la proteína S es probable que no afecten a la eficacia de las vacunas), y una respuesta celular.
Esta ha sido la primera vez que una vacuna de ARNm ha llegado a fase clínica III, por lo que había dudas de que esta tecnología fuera realmente eficaz.
El ensayo clínico incluyó alrededor de 44.000 voluntarios mayores de 16 años, de los que la mitad recibió la vacuna y la otra mitad placebo; en ambos casos desconocían de cuál de las dos opciones se trataba. De todos ellos, 36.523 voluntarios no presentaban signos previos de infección.

Se presentaron 44.000 voluntarios mayores de 16 años al ensayo clínico, donde la vacuna obtuvo una eficacia del 95% contra el virus.
Al cabo de unos meses, 170 presentaron síntomas de COVID-19: 8 de las 18.198 personas que recibieron la vacuna y 162 de las 18.325 que recibieron la inyección de placebo. Esto significa que la vacuna mostró una eficacia del 95% en el ensayo clínico. Una eficacia tan alta ya es espectacular para una vacuna, pero en el caso de esta tecnología ARNm quizá era menos esperada, por lo que fue una noticia tan importante y hay tanta esperanza en este tipo de vacunas.
¿Son seguras estas vacunas?
Según se indica en la ficha técnica de la vacuna, es un medicamento sujeto a un seguimiento adicional. Su aprobación ha sido condicional porque no hay que olvidar la situación de emergencia sanitaria internacional: la pandemia ya costó más de 1.800.000 muertes solo durante el año 2020.
La seguridad se ha evaluado en 21.744 participantes en las fases clínicas que recibieron al menos una dosis. Al igual que todas las vacunas, puede producir efectos adversos leves, aunque no todas las personas los sufran. La mayoría de estos efectos leves son debidos a que la vacuna funciona y estimula el sistema inmune.
- Efectos adversos leves muy frecuentes (más de 1 de cada 10 personas): dolor e hinchazón en el lugar de inyección, cansancio, dolor de cabeza, muscular, en las articulaciones, escalofríos y fiebre.
- Efectos frecuentes (hasta 1 de cada 10 personas): enrojecimiento en el lugar de inyección y náuseas.
- Efectos poco frecuentes (hasta 1 de cada 100 personas): aumento de tamaño de los ganglios linfáticos, malestar, dolor en la extremidad, insomnio, picor en el lugar de inyección.
- Efectos raros (hasta 1 de cada 1.000 personas): parálisis temporal de un lado de la cara.
- Frecuencia no conocida: reacción alérgica grave.
Todos los medicamentos tienen efectos secundarios y suponen un riesgo. Sobre todo, sal tener en cuenta que cada uno puede responder de manera distinta (por eso es tan importante la medicina personalizada). Tampoco hay ningún indicio de que estas vacunas supongan un riesgo para la fertilidad. Se han realizado experimentos en animales y no se han observaron efectos relacionados en la fertilidad femenina, la gestación ni el desarrollo embrionario, fetal o de las crías.
¿Pueden modificar nuestro genoma?
Se ha dicho que estas vacunas basadas en ARNm pueden modificar las funciones del genoma humano y causar daños desconocidos e irreparables. Sin embargo, lo cierto es que no hay ningún dato que sugiera que este tipo de vacunas pueda alterar nuestro ADN. La infección natural con coronavirus también produce millones de ARNm y no supone ningún riesgo para el ADN. De hecho, jamás se ha detectado un gen de un coronavirus insertado en nuestro genoma.
La molécula de ARN es muy frágil, el tiempo que permanece en las células es muy corto y desaparece fácilmente.
Además, el ARN no llega a encontrarse con el ADN: el ADN se encuentra en el núcleo de la célula y el ARNm en el citoplasma. El núcleo de la célula está rodeado de una membrana lipídica con poros por donde pueden atravesar algunas moléculas. Es cierto que algunos ARN pueden viajar al núcleo. Por ejemplo, algunos virus como el de la gripe contienen un genoma ARN que viaja hasta el núcleo de la célula, pero para eso deben asociarse a proteínas especificas con unas secuencias de aminoácidos concretas (denominadas secuencias de localización nuclear) que introducen el ARN en el núcleo.
El genoma de los coronavirus o el ARNm de la vacuna no entra de forma espontánea al núcleo, porque no se asocia a estas proteínas transportadoras.
En el caso hipotético de que entrara en el núcleo para integrarse en el ADN, el ARN debería convertirse antes en ADN a través de una enzima denominada retrotranscriptasa. Solo los retrovirus y los hepadnavirus (como el virus de la hepatitis B) tiene este tipo de enzimas y son capaces de hacerlo. Si no tienen esa enzima, no pueden integrarse en el ADN.
Pero existe otra posibilidad: el ADN nuclear contiene un tipo de secuencias genéticas móviles que pueden copiarse a sí mismas y pegarse en otras partes del genoma, denominadas retrotransposones. Estos "genes saltarines" son muy abundantes y alrededor de 42 % del genoma humano está compuesto de este tipo de elementos.
Estos retrotransposones, antes de integrarse en otro sitio del genoma, primero se convierten en ARN y después vuelven a transformarse en ADN mediante la enzima retrotranscriptasa que ellos mismos sintetizan. ¿Podría ser posible que el ARNm de la vacuna viajara al núcleo, se convirtiera en ADN y se integrara en él usando la retrotranscriptasa de estos elementos genéticos endógenos?
Para que actúe la retrotranscriptasa son necesarias unas secuencias específicas que no se encuentran en el ARN de la vacuna. Cualquier ARN que se encuentre con una retrotranscriptasa no va a convertirse en ADN, por lo que la posibilidad de que esto ocurra es prácticamente nula.
Por último, en el hipotético caso de que el ARN de la vacuna se integrara en el genoma de una de nuestras células musculares, el efecto biológico en nuestro organismo probablemente sería nulo.
Las vacunas de ARN no modifican nuestro genoma porque no afectan a nuestras células germinales o gametos.
En resumen, no hay ninguna evidencia científica en base a lo que conocemos sobre biología molecular que indique que el ARNm usado en las vacunas frente a la COVID-19 pueda tener la capacidad de alterar nuestro genoma.
Quedan preguntas pendientes
No se ha evaluado la eficacia, la seguridad ni la inmunogenicidad de la vacuna de ARNm de Pfizer/BioNtech en personas inmunodeprimidas, incluidas aquellas que estén recibiendo tratamiento inmunosupresor, ni en menores de 16 años. Se desconoce la duración de la protección proporcionada por la vacuna.
Como con cualquier vacuna, puede no proteger a todas las personas que la reciban. No se han realizado estudios de interacciones con otros medicamentos o con otras vacunas. La experiencia en mujeres embarazadas es limitada y se desconoce si se excreta en la leche materna. El impacto de la vacunación en la propagación del virus a nivel comunitario se desconoce todavía. No se sabe aún en qué grado las personas vacunadas pueden ser portadoras del virus y propagarlo.
Es verdad que todavía no hay datos de posibles efectos a largo plazo, sencillamente porque no ha dado tiempo. Por todo esto, ahora comienza lo que se denomina la fase IV de farmacovigilancia en la quese sigue evaluando la seguridad (posibles efectos secundarios muy poco frecuentes que es imposible detectar con miles de voluntarios pero que se ponen de manifiesto cuando se prueba en millones de personas) y su efectividad (si realmente funciona en el control de la epidemia).
No sería extraño que, como ocurre con otros medicamentos, alguna vacuna pueda llegar a retirarse del mercado si se detecta que no es segura o efectiva.
Hay que recordar que las agencias evaluadoras valoran también el riesgo-beneficio: el beneficio de la vacuna debe ser razonablemente mayor que el riesgo del coronavirus. Uno debería valorar qué prefiere: más de 74.000 muertos que está dejando el coronavirus en España y sus efectos colaterales o algún posible efecto secundario grave por la vacuna.
La probabilidad de contagio con SARS-CoV-2, desarrollemos la enfermedad y tenga consecuencias graves e incluso mortales, además de contagiar a otros, es mayor que los posibles efectos secundarios que pueda tener la vacuna.
El virus es silencioso y peligroso y la población no está previamente inmunizada, se transmite por el aire vía aerosoles, puede ser transmitido por personas antes de presentar los síntomas e incluso por personas que nunca manifestarán síntomas y cuya dosis infectiva probablemente sea muy baja.
En 2020, este virus ha causado más de 74.000 muertos solo en España, se han cerrado colegios y universidades, ha destrozado miles de empleos y hundido la economía, modificando las costumbres más arraigadas. Miles de personas han perdido a sus seres queridos sin poder siquiera despedirse. Se pueden esperar varios años mientras se sigan ensayando las vacunas y analizando su efecto a muy largo plazo, pero no parece lo más razonable.
La tecnología de ARNm, una nueva revolución en biomedicina
Si durante los próximas meses se confirma la seguridad a largo plazo y la efectividad de las vacunas ARNm para controlar la pandemia, es posible augurar una nueva revolución en la biomedicina. Se podrán diseñar y optimizar nuevas vacunas en un ordenador, fabricarlas bajo demanda en un tiempo récord y a bajo coste.
Se podrán diseñar vacunas múltiples contra varios patógenos al mismo tiempo, en una sola preparación. De este modo, la preparación ante una posible nueva pandemia sería mucho mejor y más rápida y se podrá avanzar hacia tratamientos personalizados contra otras enfermedades como el cáncer. Es una tecnología que puede cambiar la medicina actual, un mensaje de esperanza.
El otro día, Araceli recibió la primera vacuna contra la #COVID19. 👵🏻💉 Esto es una noticia estupenda. Pero, ¿cómo funciona la vacuna? ¿Qué es exactamente el ARN? @Elena_Turri y yo os lo explicamos en este vídeo. Y si queréis más información, seguid el #HiloCientífico 🧵 pic.twitter.com/NuG5mpiBkO
— 🧪 Fernando (@gomobel) January 2, 2021
*Ignacio López-Goñi es Catedrático de Microbiología en la Universidad de Navarra. Esta nota apareció originalmente en The Conversation y se publica aquí bajo una licencia de Creative Commons.
Así funcionan las vacunas de ARN mensajero
https://www.nationalgeographic.com.es/ciencia/asi-funcionan-vacunas-arn-mensajero_1622
La ciencia que hay detrás de la primera vacuna contra la COVID-19
Por Lluis MontoliuLa vacuna COVID-19 desarrollada por las empresas Pfizer/BioNtech tiene el nombre genérico de Tozinameran (en la International Nonproprietary Names for Pharmaceutical Substances, INN), el nombre comercial de Comirnaty, y el nombre técnico de BNT162b2.
El haber conseguido desarrollar, evaluar y aprobar la vacuna COVID-19 en menos de un año es un triunfo rotundo de la ciencia. Se trata de la primera vacuna autorizada que usa una tecnología distinta: basada en ARN. Y el éxito que vemos ahora es producto tanto de la ciencia básica que lleva investigando sobre vacunas basadas en ARN desde hace muchos años, como de la ciencia aplicada, cuando se invierten recursos formidables, nunca antes movilizados, para reducir el tiempo de evaluación de los ensayos clínicos, aumentando el número de voluntarios involucrados.
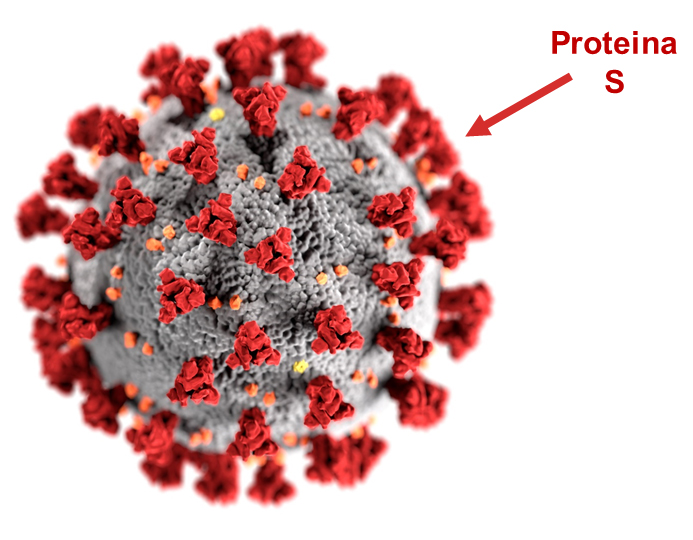
El funcionamiento de estas vacunas, basadas en ARN es simple, pero efectivo. El ARN (ácido ribonucleico) es la molécula intermediaria que transporta la información genética entre el ADN (ácido desoxirribonucleico), que está en el núcleo de la célula, y la síntesis de proteínas, que ocurre fuera del núcleo, en el citoplasma de la célula. Se trata de una molécula de ARN mensajero (mRNA) que porta la información codificada para fabricar una de las proteínas del coronavirus SARS-CoV-2, la glicoproteína S (del inglés spike, de la espícula de la corona del virus). Combinada con una mezcla de lípidos se autoorganiza como una nanogota de grasa que envuelve a la molécula de ARN y que es capaz de penetrar en el interior de las células y, una vez en el citoplasma, la información genética que transporta se traduce en forma de la proteína S codificada, usando la maquinaria ribosomal de síntesis de proteínas que tenemos en todas nuestras células. Esa proteína S así fabricada, y fragmentos de la misma, procesados por las enzimas proteasas celulares, son los que acaban exponiéndose en la superficie de la célula vacunada e inducen la respuesta de nuestro sistema inmunitario, que reconoce a estas proteínas como extrañas, no propias, y desata la producción de anticuerpos y de linfocitos contra ella. Se trata de una respuesta policlonal, contra diferentes partes de la proteína S, lo cual garantiza que aunque aparezcan nuevas mutaciones en esta proteína S siempre habrá otras partes de la misma que seguirán siendo diana de la respuesta inmunitaria. Una vez activado el sistema inmunitario por la vacuna COVID-19 la próxima vez que la persona vacunada se vea expuesta al coronavirus SARS-CoV-2 nuestro sistema inmunitario reconocerá la proteína S de su superficie, recordará que tiene anticuerpos y linfocitos contra ella, aumentará la producción de todos ellos y conseguirá inactivar al coronavirus, impidiendo que la infección progrese. Simple pero efectivo. Las estupendas infografías preparadas por los periódicos The New York Times y Materia/El País ilustran perfectamente todo este proceso.
Hasta aquí lo que generalmente sabemos y leemos sobre esta primera vacuna contra la COVID-19. Pero:
- ¿Qué sabemos de la ciencia que hay detrás de ella?
- ¿Cuál es la secuencia genética de ARN que se utiliza exactamente?
- ¿Tiene alguna modificación en relación a la secuencia conocida del coronavirus SARS-CoV-2?
- ¿Cómo garantizar que el mRNA llegue al interior de las células y se traduzca eficazmente?
- ¿Cuáles son los lípidos que se usan para mezclarlos con el ARN para constituir la vacuna?
Veamos a continuación todos estos detalles, principalmente los relacionados con la genética de esta primera vacuna contra la COVID-19.
Según el informe de evaluación realizado por la EMA el ARN de la vacuna Comirnaty (Pfizer/BioNtech) se ha preparado a partir de la secuencia de ARN del genoma original del coronavirus SARS-CoV-2, aislado de Wuhan-Hu-1, cuya secuencia completa de 29,903 ribonucleótidos de ARN de cadena sencilla se depositó en GenBank (MN908947.3) y cuya secuencia de aminoácidos codificados de la glicoproteína S corresponde a QHD43416.1.
A continuación muestro la secuencia original de 3822 ribonucleótidos de ARN de cadena sencilla (ssRNA) que corresponde a la secuencia codificada para la glicoproteína S, en las coordenadas 21563 a 25384, de la secuencia de referencia MN908947.3. Al tratarse de ARN las cuatro bases nitrogenadas son la A, C, G y la U (uracilo), que substituye a la T del ADN.
RNA sequence encoding surface glycoprotein "S" (3,822 ssRNA) Coordinates: 21563..25384
AUGUUUGUUUUUCUUGUUUUAUUGCCACUAGUCUCUAGUCAGUGUGUUAAUCUUACAACCAGAACUCAAUUACCCCCUGCAUACACUAAUUCUUUCACA
CGUGGUGUUUAUUACCCUGACAAAGUUUUCAGAUCCUCAGUUUUACAUUCAACUCAGGACUUGUUCUUACCUUUCUUUUCCAAUGUUACUUGGUUCCAU
GCUAUACAUGUCUCUGGGACCAAUGGUACUAAGAGGUUUGAUAACCCUGUCCUACCAUUUAAUGAUGGUGUUUAUUUUGCUUCCACUGAGAAGUCUAAC
AUAAUAAGAGGCUGGAUUUUUGGUACUACUUUAGAUUCGAAGACCCAGUCCCUACUUAUUGUUAAUAACGCUACUAAUGUUGUUAUUAAAGUCUGUGAA
UUUCAAUUUUGUAAUGAUCCAUUUUUGGGUGUUUAUUACCACAAAAACAACAAAAGUUGGAUGGAAAGUGAGUUCAGAGUUUAUUCUAGUGCGAAUAAU
UGCACUUUUGAAUAUGUCUCUCAGCCUUUUCUUAUGGACCUUGAAGGAAAACAGGGUAAUUUCAAAAAUCUUAGGGAAUUUGUGUUUAAGAAUAUUGAU
GGUUAUUUUAAAAUAUAUUCUAAGCACACGCCUAUUAAUUUAGUGCGUGAUCUCCCUCAGGGUUUUUCGGCUUUAGAACCAUUGGUAGAUUUGCCAAUA
GGUAUUAACAUCACUAGGUUUCAAACUUUACUUGCUUUACAUAGAAGUUAUUUGACUCCUGGUGAUUCUUCUUCAGGUUGGACAGCUGGUGCUGCAGCU
UAUUAUGUGGGUUAUCUUCAACCUAGGACUUUUCUAUUAAAAUAUAAUGAAAAUGGAACCAUUACAGAUGCUGUAGACUGUGCACUUGACCCUCUCUCA
GAAACAAAGUGUACGUUGAAAUCCUUCACUGUAGAAAAAGGAAUCUAUCAAACUUCUAACUUUAGAGUCCAACCAACAGAAUCUAUUGUUAGAUUUCCU
AAUAUUACAAACUUGUGCCCUUUUGGUGAAGUUUUUAACGCCACCAGAUUUGCAUCUGUUUAUGCUUGGAACAGGAAGAGAAUCAGCAACUGUGUUGCU
GAUUAUUCUGUCCUAUAUAAUUCCGCAUCAUUUUCCACUUUUAAGUGUUAUGGAGUGUCUCCUACUAAAUUAAAUGAUCUCUGCUUUACUAAUGUCUAU
GCAGAUUCAUUUGUAAUUAGAGGUGAUGAAGUCAGACAAAUCGCUCCAGGGCAAACUGGAAAGAUUGCUGAUUAUAAUUAUAAAUUACCAGAUGAUUUU
ACAGGCUGCGUUAUAGCUUGGAAUUCUAACAAUCUUGAUUCUAAGGUUGGUGGUAAUUAUAAUUACCUGUAUAGAUUGUUUAGGAAGUCUAAUCUCAAA
CCUUUUGAGAGAGAUAUUUCAACUGAAAUCUAUCAGGCCGGUAGCACACCUUGUAAUGGUGUUGAAGGUUUUAAUUGUUACUUUCCUUUACAAUCAUAU
GGUUUCCAACCCACUAAUGGUGUUGGUUACCAACCAUACAGAGUAGUAGUACUUUCUUUUGAACUUCUACAUGCACCAGCAACUGUUUGUGGACCUAAA
AAGUCUACUAAUUUGGUUAAAAACAAAUGUGUCAAUUUCAACUUCAAUGGUUUAACAGGCACAGGUGUUCUUACUGAGUCUAACAAAAAGUUUCUGCCU
UUCCAACAAUUUGGCAGAGACAUUGCUGACACUACUGAUGCUGUCCGUGAUCCACAGACACUUGAGAUUCUUGACAUUACACCAUGUUCUUUUGGUGGU
GUCAGUGUUAUAACACCAGGAACAAAUACUUCUAACCAGGUUGCUGUUCUUUAUCAGGAUGUUAACUGCACAGAAGUCCCUGUUGCUAUUCAUGCAGAU
CAACUUACUCCUACUUGGCGUGUUUAUUCUACAGGUUCUAAUGUUUUUCAAACACGUGCAGGCUGUUUAAUAGGGGCUGAACAUGUCAACAACUCAUAU
GAGUGUGACAUACCCAUUGGUGCAGGUAUAUGCGCUAGUUAUCAGACUCAGACUAAUUCUCCUCGGCGGGCACGUAGUGUAGCUAGUCAAUCCAUCAUU
GCCUACACUAUGUCACUUGGUGCAGAAAAUUCAGUUGCUUACUCUAAUAACUCUAUUGCCAUACCCACAAAUUUUACUAUUAGUGUUACCACAGAAAUU
CUACCAGUGUCUAUGACCAAGACAUCAGUAGAUUGUACAAUGUACAUUUGUGGUGAUUCAACUGAAUGCAGCAAUCUUUUGUUGCAAUAUGGCAGUUUU
UGUACACAAUUAAACCGUGCUUUAACUGGAAUAGCUGUUGAACAAGACAAAAACACCCAAGAAGUUUUUGCACAAGUCAAACAAAUUUACAAAACACCA
CCAAUUAAAGAUUUUGGUGGUUUUAAUUUUUCACAAAUAUUACCAGAUCCAUCAAAACCAAGCAAGAGGUCAUUUAUUGAAGAUCUACUUUUCAACAAA
GUGACACUUGCAGAUGCUGGCUUCAUCAAACAAUAUGGUGAUUGCCUUGGUGAUAUUGCUGCUAGAGACCUCAUUUGUGCACAAAAGUUUAACGGCCUU
ACUGUUUUGCCACCUUUGCUCACAGAUGAAAUGAUUGCUCAAUACACUUCUGCACUGUUAGCGGGUACAAUCACUUCUGGUUGGACCUUUGGUGCAGGU
GCUGCAUUACAAAUACCAUUUGCUAUGCAAAUGGCUUAUAGGUUUAAUGGUAUUGGAGUUACACAGAAUGUUCUCUAUGAGAACCAAAAAUUGAUUGCC
AACCAAUUUAAUAGUGCUAUUGGCAAAAUUCAAGACUCACUUUCUUCCACAGCAAGUGCACUUGGAAAACUUCAAGAUGUGGUCAACCAAAAUGCACAA
GCUUUAAACACGCUUGUUAAACAACUUAGCUCCAAUUUUGGUGCAAUUUCAAGUGUUUUAAAUGAUAUCCUUUCACGUCUUGACAAAGUUGAGGCUGAA
GUGCAAAUUGAUAGGUUGAUCACAGGCAGACUUCAAAGUUUGCAGACAUAUGUGACUCAACAAUUAAUUAGAGCUGCAGAAAUCAGAGCUUCUGCUAAU
CUUGCUGCUACUAAAAUGUCAGAGUGUGUACUUGGACAAUCAAAAAGAGUUGAUUUUUGUGGAAAGGGCUAUCAUCUUAUGUCCUUCCCUCAGUCAGCA
CCUCAUGGUGUAGUCUUCUUGCAUGUGACUUAUGUCCCUGCACAAGAAAAGAACUUCACAACUGCUCCUGCCAUUUGUCAUGAUGGAAAAGCACACUUU
CCUCGUGAAGGUGUCUUUGUUUCAAAUGGCACACACUGGUUUGUAACACAAAGGAAUUUUUAUGAACCACAAAUCAUUACUACAGACAACACAUUUGUG
UCUGGUAACUGUGAUGUUGUAAUAGGAAUUGUCAACAACACAGUUUAUGAUCCUUUGCAACCUGAAUUAGACUCAUUCAAGGAGGAGUUAGAUAAAUAU
UUUAAGAAUCAUACAUCACCAGAUGUUGAUUUAGGUGACAUCUCUGGCAUUAAUGCUUCAGUUGUAAACAUUCAAAAAGAAAUUGACCGCCUCAAUGAG
GUUGCCAAGAAUUUAAAUGAAUCUCUCAUCGAUCUCCAAGAACUUGGAAAGUAUGAGCAGUAUAUAAAAUGGCCAUGGUACAUUUGGCUAGGUUUUAUA
GCUGGCUUGAUUGCCAUAGUAAUGGUGACAAUUAUGCUUUGCUGUAUGACCAGUUGCUGUAGUUGUCUCAAGGGCUGUUGUUCUUGUGGAUCCUGCUGC
AAAUUUGAUGAAGACGACUCUGAGCCAGUGCUCAAAGGAGUCAAAUUACAUUACACAUAA
A continuación muestro la secuencia original de 1273 aminoácidos codificados para la glicoproteína S de la secuencia de referencia QHD43416.1. Los aminoácidos K (lisina) y V (valina) en las posiciones 986 y 987 están resaltados en azul e indican las dos posiciones que se mutaron a P (prolina) en la secuencia final del mRNA utilizado, para bloquear la conformación de la proteína S en el estado prefusión con el receptor, con una antigenicidad óptima, de acuerdo a los estudios estructurales realizados por Wrapp y col. (2020).
>QHD43416.1 surface glycoprotein [Severe acute respiratory syndrome coronavirus 2] 1273 aminoacides MFVFLVLLPLVSSQCVNLTTRTQLPPAYTNSFTRGVYYPDKVFRSSVLHSTQDLFLPFFSNVTWFHAIHVSGTNGTKRFDNPVLPFNDGVYFASTEKSN IIRGWIFGTTLDSKTQSLLIVNNATNVVIKVCEFQFCNDPFLGVYYHKNNKSWMESEFRVYSSANNCTFEYVSQPFLMDLEGKQGNFKNLREFVFKNID GYFKIYSKHTPINLVRDLPQGFSALEPLVDLPIGINITRFQTLLALHRSYLTPGDSSSGWTAGAAAYYVGYLQPRTFLLKYNENGTITDAVDCALDPLS ETKCTLKSFTVEKGIYQTSNFRVQPTESIVRFPNITNLCPFGEVFNATRFASVYAWNRKRISNCVADYSVLYNSASFSTFKCYGVSPTKLNDLCFTNVY ADSFVIRGDEVRQIAPGQTGKIADYNYKLPDDFTGCVIAWNSNNLDSKVGGNYNYLYRLFRKSNLKPFERDISTEIYQAGSTPCNGVEGFNCYFPLQSY GFQPTNGVGYQPYRVVVLSFELLHAPATVCGPKKSTNLVKNKCVNFNFNGLTGTGVLTESNKKFLPFQQFGRDIADTTDAVRDPQTLEILDITPCSFGG VSVITPGTNTSNQVAVLYQDVNCTEVPVAIHADQLTPTWRVYSTGSNVFQTRAGCLIGAEHVNNSYECDIPIGAGICASYQTQTNSPRRARSVASQSII AYTMSLGAENSVAYSNNSIAIPTNFTISVTTEILPVSMTKTSVDCTMYICGDSTECSNLLLQYGSFCTQLNRALTGIAVEQDKNTQEVFAQVKQIYKTP PIKDFGGFNFSQILPDPSKPSKRSFIEDLLFNKVTLADAGFIKQYGDCLGDIAARDLICAQKFNGLTVLPPLLTDEMIAQYTSALLAGTITSGWTFGAG AALQIPFAMQMAYRFNGIGVTQNVLYENQKLIANQFNSAIGKIQDSLSSTASALGKLQDVVNQNAQALNTLVKQLSSNFGAISSVLNDILSRLDKVEAE VQIDRLITGRLQSLQTYVTQQLIRAAEIRASANLAATKMSECVLGQSKRVDFCGKGYHLMSFPQSAPHGVVFLHVTYVPAQEKNFTTAPAICHDGKAHF PREGVFVSNGTHWFVTQRNFYEPQIITTDNTFVSGNCDVVIGIVNNTVYDPLQPELDSFKEELDKYFKNHTSPDVDLGDISGINASVVNIQKEIDRLNE VAKNLNESLIDLQELGKYEQYIKWPWYIWLGFIAGLIAIVMVTIMLCCMTSCCSCLKGCCSCGSCCKFDEDDSEPVLKGVKLHYT
En principio alguien podría pensar que ya estaría. Se sintetiza esa molécula de ARN y ya se puede mezclar con los lípidos para generar la vacuna. En realidad no es así. Hacen falta todavía muchas modificaciones para que un fragmento de ARN de la secuencia original que codifica la glicoproteína S se convierta en la vacuna Comirnaty desarrollada por Pfizer/BioNtech y aprobada por la FDA y la EMA.
Para empezar, si usáramos esa molécula de ARN tal cual induciríamos una respuesta celular inmunogénica innata (la célula interpretaría ese ARN como un ARN foráneo) mediada por los receptores de membrana Toll-like TLR3, TLR7 y TLR8 y por los receptores citoplasmáticos inducibles por ácido retinoico RIA, que incrementa los niveles circulantes de Interferón-alfa y que montarían una respuesta inmune contra ese ARN, lo cual sería peligroso y tornaría a la estrategia en inútil para usarla como vacuna. Afortunadamente, la investigación básica realizada anteriormente por Kariko y col. (2008) y por Durbin y col. (2016), entre otros trabajos, demostraron que el uso de nucleósidos modificados existentes en la naturaleza como la pseudouridina o la 1-metil-3′-pseudouridina no inducen esa respuesta inmunogénica contra el ARN. Posteriormente también se comprobó que la 1-metil-3′-pseudouridina, además de todo lo anterior, también aumentaba la capacidad de traducción, gracias a el trabajo de Svitkin et al. (2017), en el que también colaboraron investigadores de la empresa Moderna Therapeutics, la otra empresa que también ha desarrollado otra vacuna COVID-19 basada en ARN, y que también ya ha sido autorizada por la FDA. Por esta razón los investigadores de BioNtech decidieron cambiar todas las uridinas (U) del ARN por 1-metil-3′-pseudouridina (Ψ). Por lo tanto la secuencia original de ARN que codifica la glicoproteína S se convierte en principio a la siguiente:
RNA sequence encoding surface glycoprotein "S" using ᴪ instead of U AΨGΨΨΨGΨΨΨΨΨCΨΨGΨΨΨΨAΨΨGCCACΨAGΨCΨCΨAGΨCAGΨGΨGΨΨAAΨCΨΨACAACCAGAACΨCAAΨΨACCCCCΨGCAΨACACΨAAΨΨCΨΨΨCACA CGΨGGΨGΨΨΨAΨΨACCCΨGACAAAGΨΨΨΨCAGAΨCCΨCAGΨΨΨΨACAΨΨCAACΨCAGGACΨΨGΨΨCΨΨACCΨΨΨCΨΨΨΨCCAAΨGΨΨACΨΨGGΨΨCCAΨ GCΨAΨACAΨGΨCΨCΨGGGACCAAΨGGΨACΨAAGAGGΨΨΨGAΨAACCCΨGΨCCΨACCAΨΨΨAAΨGAΨGGΨGΨΨΨAΨΨΨΨGCΨΨCCACΨGAGAAGΨCΨAAC AΨAAΨAAGAGGCΨGGAΨΨΨΨΨGGΨACΨACΨΨΨAGAΨΨCGAAGACCCAGΨCCCΨACΨΨAΨΨGΨΨAAΨAACGCΨACΨAAΨGΨΨGΨΨAΨΨAAAGΨCΨGΨGAA ΨΨΨCAAΨΨΨΨGΨAAΨGAΨCCAΨΨΨΨΨGGGΨGΨΨΨAΨΨACCACAAAAACAACAAAAGΨΨGGAΨGGAAAGΨGAGΨΨCAGAGΨΨΨAΨΨCΨAGΨGCGAAΨAAΨ ΨGCACΨΨΨΨGAAΨAΨGΨCΨCΨCAGCCΨΨΨΨCΨΨAΨGGACCΨΨGAAGGAAAACAGGGΨAAΨΨΨCAAAAAΨCΨΨAGGGAAΨΨΨGΨGΨΨΨAAGAAΨAΨΨGAΨ GGΨΨAΨΨΨΨAAAAΨAΨAΨΨCΨAAGCACACGCCΨAΨΨAAΨΨΨAGΨGCGΨGAΨCΨCCCΨCAGGGΨΨΨΨΨCGGCΨΨΨAGAACCAΨΨGGΨAGAΨΨΨGCCAAΨA GGΨAΨΨAACAΨCACΨAGGΨΨΨCAAACΨΨΨACΨΨGCΨΨΨACAΨAGAAGΨΨAΨΨΨGACΨCCΨGGΨGAΨΨCΨΨCΨΨCAGGΨΨGGACAGCΨGGΨGCΨGCAGCΨ ΨAΨΨAΨGΨGGGΨΨAΨCΨΨCAACCΨAGGACΨΨΨΨCΨAΨΨAAAAΨAΨAAΨGAAAAΨGGAACCAΨΨACAGAΨGCΨGΨAGACΨGΨGCACΨΨGACCCΨCΨCΨCA GAAACAAAGΨGΨACGΨΨGAAAΨCCΨΨCACΨGΨAGAAAAAGGAAΨCΨAΨCAAACΨΨCΨAACΨΨΨAGAGΨCCAACCAACAGAAΨCΨAΨΨGΨΨAGAΨΨΨCCΨ AAΨAΨΨACAAACΨΨGΨGCCCΨΨΨΨGGΨGAAGΨΨΨΨΨAACGCCACCAGAΨΨΨGCAΨCΨGΨΨΨAΨGCΨΨGGAACAGGAAGAGAAΨCAGCAACΨGΨGΨΨGCΨ GAΨΨAΨΨCΨGΨCCΨAΨAΨAAΨΨCCGCAΨCAΨΨΨΨCCACΨΨΨΨAAGΨGΨΨAΨGGAGΨGΨCΨCCΨACΨAAAΨΨAAAΨGAΨCΨCΨGCΨΨΨACΨAAΨGΨCΨAΨ GCAGAΨΨCAΨΨΨGΨAAΨΨAGAGGΨGAΨGAAGΨCAGACAAAΨCGCΨCCAGGGCAAACΨGGAAAGAΨΨGCΨGAΨΨAΨAAΨΨAΨAAAΨΨACCAGAΨGAΨΨΨΨ ACAGGCΨGCGΨΨAΨAGCΨΨGGAAΨΨCΨAACAAΨCΨΨGAΨΨCΨAAGGΨΨGGΨGGΨAAΨΨAΨAAΨΨACCΨGΨAΨAGAΨΨGΨΨΨAGGAAGΨCΨAAΨCΨCAAA CCΨΨΨΨGAGAGAGAΨAΨΨΨCAACΨGAAAΨCΨAΨCAGGCCGGΨAGCACACCΨΨGΨAAΨGGΨGΨΨGAAGGΨΨΨΨAAΨΨGΨΨACΨΨΨCCΨΨΨACAAΨCAΨAΨ GGΨΨΨCCAACCCACΨAAΨGGΨGΨΨGGΨΨACCAACCAΨACAGAGΨAGΨAGΨACΨΨΨCΨΨΨΨGAACΨΨCΨACAΨGCACCAGCAACΨGΨΨΨGΨGGACCΨAAA AAGΨCΨACΨAAΨΨΨGGΨΨAAAAACAAAΨGΨGΨCAAΨΨΨCAACΨΨCAAΨGGΨΨΨAACAGGCACAGGΨGΨΨCΨΨACΨGAGΨCΨAACAAAAAGΨΨΨCΨGCCΨ ΨΨCCAACAAΨΨΨGGCAGAGACAΨΨGCΨGACACΨACΨGAΨGCΨGΨCCGΨGAΨCCACAGACACΨΨGAGAΨΨCΨΨGACAΨΨACACCAΨGΨΨCΨΨΨΨGGΨGGΨ GΨCAGΨGΨΨAΨAACACCAGGAACAAAΨACΨΨCΨAACCAGGΨΨGCΨGΨΨCΨΨΨAΨCAGGAΨGΨΨAACΨGCACAGAAGΨCCCΨGΨΨGCΨAΨΨCAΨGCAGAΨ CAACΨΨACΨCCΨACΨΨGGCGΨGΨΨΨAΨΨCΨACAGGΨΨCΨAAΨGΨΨΨΨΨCAAACACGΨGCAGGCΨGΨΨΨAAΨAGGGGCΨGAACAΨGΨCAACAACΨCAΨAΨ GAGΨGΨGACAΨACCCAΨΨGGΨGCAGGΨAΨAΨGCGCΨAGΨΨAΨCAGACΨCAGACΨAAΨΨCΨCCΨCGGCGGGCACGΨAGΨGΨAGCΨAGΨCAAΨCCAΨCAΨΨ GCCΨACACΨAΨGΨCACΨΨGGΨGCAGAAAAΨΨCAGΨΨGCΨΨACΨCΨAAΨAACΨCΨAΨΨGCCAΨACCCACAAAΨΨΨΨACΨAΨΨAGΨGΨΨACCACAGAAAΨΨ CΨACCAGΨGΨCΨAΨGACCAAGACAΨCAGΨAGAΨΨGΨACAAΨGΨACAΨΨΨGΨGGΨGAΨΨCAACΨGAAΨGCAGCAAΨCΨΨΨΨGΨΨGCAAΨAΨGGCAGΨΨΨΨ ΨGΨACACAAΨΨAAACCGΨGCΨΨΨAACΨGGAAΨAGCΨGΨΨGAACAAGACAAAAACACCCAAGAAGΨΨΨΨΨGCACAAGΨCAAACAAAΨΨΨACAAAACACCA CCAAΨΨAAAGAΨΨΨΨGGΨGGΨΨΨΨAAΨΨΨΨΨCACAAAΨAΨΨACCAGAΨCCAΨCAAAACCAAGCAAGAGGΨCAΨΨΨAΨΨGAAGAΨCΨACΨΨΨΨCAACAAA GΨGACACΨΨGCAGAΨGCΨGGCΨΨCAΨCAAACAAΨAΨGGΨGAΨΨGCCΨΨGGΨGAΨAΨΨGCΨGCΨAGAGACCΨCAΨΨΨGΨGCACAAAAGΨΨΨAACGGCCΨΨ ACΨGΨΨΨΨGCCACCΨΨΨGCΨCACAGAΨGAAAΨGAΨΨGCΨCAAΨACACΨΨCΨGCACΨGΨΨAGCGGGΨACAAΨCACΨΨCΨGGΨΨGGACCΨΨΨGGΨGCAGGΨ GCΨGCAΨΨACAAAΨACCAΨΨΨGCΨAΨGCAAAΨGGCΨΨAΨAGGΨΨΨAAΨGGΨAΨΨGGAGΨΨACACAGAAΨGΨΨCΨCΨAΨGAGAACCAAAAAΨΨGAΨΨGCC AACCAAΨΨΨAAΨAGΨGCΨAΨΨGGCAAAAΨΨCAAGACΨCACΨΨΨCΨΨCCACAGCAAGΨGCACΨΨGGAAAACΨΨCAAGAΨGΨGGΨCAACCAAAAΨGCACAA GCΨΨΨAAACACGCΨΨGΨΨAAACAACΨΨAGCΨCCAAΨΨΨΨGGΨGCAAΨΨΨCAAGΨGΨΨΨΨAAAΨGAΨAΨCCΨΨΨCACGΨCΨΨGACAAAGΨΨGAGGCΨGAA GΨGCAAAΨΨGAΨAGGΨΨGAΨCACAGGCAGACΨΨCAAAGΨΨΨGCAGACAΨAΨGΨGACΨCAACAAΨΨAAΨΨAGAGCΨGCAGAAAΨCAGAGCΨΨCΨGCΨAAΨ CΨΨGCΨGCΨACΨAAAAΨGΨCAGAGΨGΨGΨACΨΨGGACAAΨCAAAAAGAGΨΨGAΨΨΨΨΨGΨGGAAAGGGCΨAΨCAΨCΨΨAΨGΨCCΨΨCCCΨCAGΨCAGCA CCΨCAΨGGΨGΨAGΨCΨΨCΨΨGCAΨGΨGACΨΨAΨGΨCCCΨGCACAAGAAAAGAACΨΨCACAACΨGCΨCCΨGCCAΨΨΨGΨCAΨGAΨGGAAAAGCACACΨΨΨ CCΨCGΨGAAGGΨGΨCΨΨΨGΨΨΨCAAAΨGGCACACACΨGGΨΨΨGΨAACACAAAGGAAΨΨΨΨΨAΨGAACCACAAAΨCAΨΨACΨACAGACAACACAΨΨΨGΨG ΨCΨGGΨAACΨGΨGAΨGΨΨGΨAAΨAGGAAΨΨGΨCAACAACACAGΨΨΨAΨGAΨCCΨΨΨGCAACCΨGAAΨΨAGACΨCAΨΨCAAGGAGGAGΨΨAGAΨAAAΨAΨ ΨΨΨAAGAAΨCAΨACAΨCACCAGAΨGΨΨGAΨΨΨAGGΨGACAΨCΨCΨGGCAΨΨAAΨGCΨΨCAGΨΨGΨAAACAΨΨCAAAAAGAAAΨΨGACCGCCΨCAAΨGAG GΨΨGCCAAGAAΨΨΨAAAΨGAAΨCΨCΨCAΨCGAΨCΨCCAAGAACΨΨGGAAAGΨAΨGAGCAGΨAΨAΨAAAAΨGGCCAΨGGΨACAΨΨΨGGCΨAGGΨΨΨΨAΨA GCΨGGCΨΨGAΨΨGCCAΨAGΨAAΨGGΨGACAAΨΨAΨGCΨΨΨGCΨGΨAΨGACCAGΨΨGCΨGΨAGΨΨGΨCΨCAAGGGCΨGΨΨGΨΨCΨΨGΨGGAΨCCΨGCΨGC AAAΨΨΨGAΨGAAGACGACΨCΨGAGCCAGΨGCΨCAAAGGAGΨCAAAΨΨACAΨΨACACAΨAA
Pero todavía no es suficiente. Esta molécula de ARN, a pesar de tener pseudouridinas en lugar de uridinas, todavía sería muy poco estable y hay que añadirle señales de protección en el extremo 5′ (estructura CAP, característica de todos los mRNAs) y una cola de poliadeninas en el extremo 3′, además de otras señales de estabilización y de optimización de la traducción (como el uso de codones optimizados para las células humanas). Hay 20 aminoácidos y 64 posibles combinaciones de 3 letras-ribonucleótidos en el código genético, (incluidas tres señales de paro de traducción), por lo tanto varios codones de ARN codifican para el mismo aminoácido y no todos se usan con igual frecuencia en todas las especies, probablemente relacionado con la abundancia relativa de los t-RNA correspondientes, de ahí la frecuente «optimización» de los codones a la especie que va a traducir el ARN, una aproximación habitual pero no exenta de problemas.
Veamos en esta mapa (obtenido de la WHO-INN) las señales que se le añaden al ARN modificado.
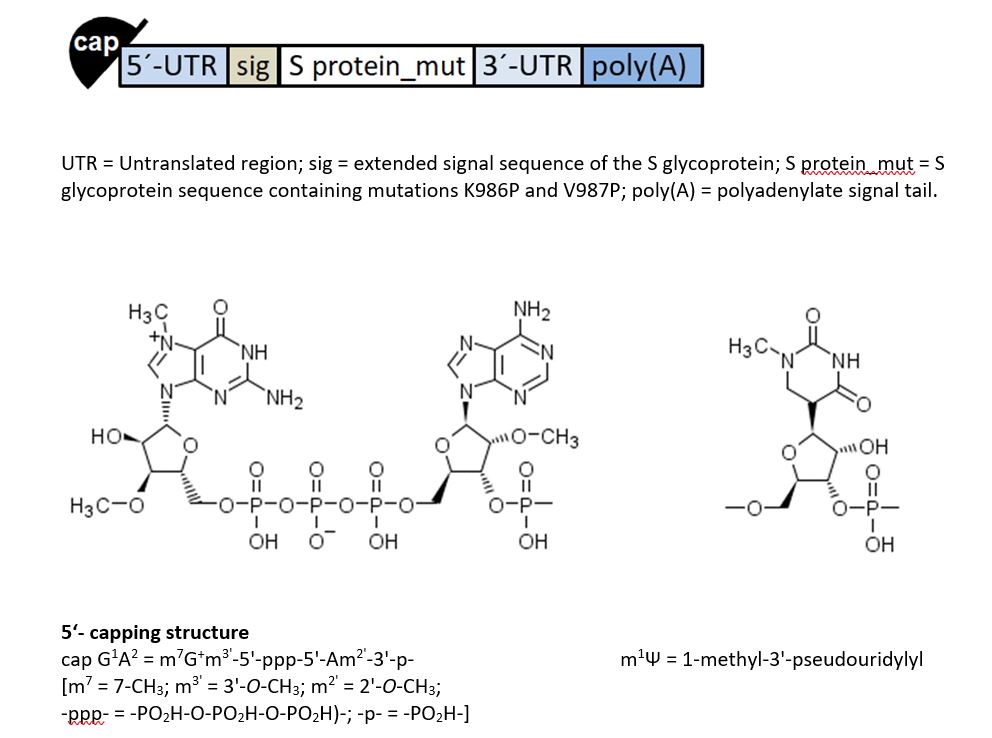
Las señales que se le añaden en el extremo 5′ (izquierda) de la molécula de ARN son:
- 5′-CAP: Estructura CAP modificada. 5’-cap1 (m7G+m3′-5′-ppp-5′-Am), posiciones 1-2
- 5′-UTR: Región no traducida en 5′ derivada del ARN del gen de la alfa-globina humana con una secuencia Kozak (de inicio de traducción) optimizada, posiciones 3-54
- sig: Secuencia que codifica el péptido señal de la glicoproteína S (secuencia extendida de la región líder/inicial) encargada de guiar la traslocación del polipéptido sintetizado hacia el retículo endoplasmático (para que finalmente llegue a exponerse en la membrana citoplasmática de la célula a través de los sistemas membranosos endocelulares: retículo endoplasmático, aparato de golgi y membrana exterior). Esta secuencia ya está originalmente en la glicoproteína S codificada en el genoma del coronavirus, posiciones 55-102
- S protein_mut: Secuencia de ARN (con codones optimizados, para su mejor capacidad de traducción, de acuerdo a las frecuencias de codones habitualmente usados en células humanas) que codifica la glicoproteína S mutada, con cambios en las posiciones codificadas K986P y V987P, y con dos codones de STOP al final, posiciones 103-3879
- 3′-UTR: Región no traducida en 3′ que comprende dos secuencias derivadas del mRNA del amino-terminal enhancer of split (AES) y del RNA 12S ribosomal mitocondrial, que confieren estabilidad al ARN y un aumento en la cantidad total de proteína traducida, posiciones 3880-4174
- poly(A): Secuencia de 110 ribonucleótidos que conforma la cola poli-A y que consiste en una ristra de 30 residuos de adenosina (A), seguido de una secuencia de unión de 10 ribonucleótidos y de 70 residuos de adenosina (A) adicionales, posiciones 4175-4284
Con todas esas modificaciones incorporadas la secuencia del mRNA final de la vacuna COVID-19 Comirnaty desarrollada por Pfizer/BioNtech (que es bastante distinta al ARN original mostrado anteriormente) corresponde a la siguiente secuencia. En verde se destacan las secuencias 5′-UTR y 3′-UTR. En rojo se destaca la secuencia que codifica el péptido señal que manda la proteína al retículo endoplasmático. Aparecen subrayados dos codones stop ΨGAΨGA. El resto corresponde a la versión optimizada que codifica para la glicoproteína S mutada (con los cambios K986P y V987P, cuya secuencia en el mRNA se destaca en azul).
GAGAAΨAAAC ΨAGΨAΨΨCΨΨ CΨGGΨCCCCA CAGACΨCAGA GAGAACCCGC 50 CACCAΨGΨΨC GΨGΨΨCCΨGG ΨGCΨGCΨGCC ΨCΨGGΨGΨCC AGCCAGΨGΨG 100 ΨGAACCΨGAC CACCAGAACA CAGCΨGCCΨC CAGCCΨACAC CAACAGCΨΨΨ 150 ACCAGAGGCG ΨGΨACΨACCC CGACAAGGΨG ΨΨCAGAΨCCA GCGΨGCΨGCA 200 CΨCΨACCCAG GACCΨGΨΨCC ΨGCCΨΨΨCΨΨ CAGCAACGΨG ACCΨGGΨΨCC 250 ACGCCAΨCCA CGΨGΨCCGGC ACCAAΨGGCA CCAAGAGAΨΨ CGACAACCCC 300 GΨGCΨGCCCΨ ΨCAACGACGG GGΨGΨACΨΨΨ GCCAGCACCG AGAAGΨCCAA 350 CAΨCAΨCAGA GGCΨGGAΨCΨ ΨCGGCACCAC ACΨGGACAGC AAGACCCAGA 400 GCCΨGCΨGAΨ CGΨGAACAAC GCCACCAACG ΨGGΨCAΨCAA AGΨGΨGCGAG 450 ΨΨCCAGΨΨCΨ GCAACGACCC CΨΨCCΨGGGC GΨCΨACΨACC ACAAGAACAA 500 CAAGAGCΨGG AΨGGAAAGCG AGΨΨCCGGGΨ GΨACAGCAGC GCCAACAACΨ 550 GCACCΨΨCGA GΨACGΨGΨCC CAGCCΨΨΨCC ΨGAΨGGACCΨ GGAAGGCAAG 600 CAGGGCAACΨ ΨCAAGAACCΨ GCGCGAGΨΨC GΨGΨΨΨAAGA ACAΨCGACGG 650 CΨACΨΨCAAG AΨCΨACAGCA AGCACACCCC ΨAΨCAACCΨC GΨGCGGGAΨC 700 ΨGCCΨCAGGG CΨΨCΨCΨGCΨ CΨGGAACCCC ΨGGΨGGAΨCΨ GCCCAΨCGGC 750 AΨCAACAΨCA CCCGGΨΨΨCA GACACΨGCΨG GCCCΨGCACA GAAGCΨACCΨ 800 GACACCΨGGC GAΨAGCAGCA GCGGAΨGGAC AGCΨGGΨGCC GCCGCΨΨACΨ 850 AΨGΨGGGCΨA CCΨGCAGCCΨ AGAACCΨΨCC ΨGCΨGAAGΨA CAACGAGAAC 900 GGCACCAΨCA CCGACGCCGΨ GGAΨΨGΨGCΨ CΨGGAΨCCΨC ΨGAGCGAGAC 950 AAAGΨGCACC CΨGAAGΨCCΨ ΨCACCGΨGGA AAAGGGCAΨC ΨACCAGACCA 1000 GCAACΨΨCCG GGΨGCAGCCC ACCGAAΨCCA ΨCGΨGCGGΨΨ CCCCAAΨAΨC 1050 ACCAAΨCΨGΨ GCCCCΨΨCGG CGAGGΨGΨΨC AAΨGCCACCA GAΨΨCGCCΨC 1100 ΨGΨGΨACGCC ΨGGAACCGGA AGCGGAΨCAG CAAΨΨGCGΨG GCCGACΨACΨ 1150 CCGΨGCΨGΨA CAACΨCCGCC AGCΨΨCAGCA CCΨΨCAAGΨG CΨACGGCGΨG 1200 ΨCCCCΨACCA AGCΨGAACGA CCΨGΨGCΨΨC ACAAACGΨGΨ ACGCCGACAG 1250 CΨΨCGΨGAΨC CGGGGAGAΨG AAGΨGCGGCA GAΨΨGCCCCΨ GGACAGACAG 1300 GCAAGAΨCGC CGACΨACAAC ΨACAAGCΨGC CCGACGACΨΨ CACCGGCΨGΨ 1350 GΨGAΨΨGCCΨ GGAACAGCAA CAACCΨGGAC ΨCCAAAGΨCG GCGGCAACΨA 1400 CAAΨΨACCΨG ΨACCGGCΨGΨ ΨCCGGAAGΨC CAAΨCΨGAAG CCCΨΨCGAGC 1450 GGGACAΨCΨC CACCGAGAΨC ΨAΨCAGGCCG GCAGCACCCC ΨΨGΨAACGGC 1500 GΨGGAAGGCΨ ΨCAACΨGCΨA CΨΨCCCACΨG CAGΨCCΨACG GCΨΨΨCAGCC 1550 CACAAAΨGGC GΨGGGCΨAΨC AGCCCΨACAG AGΨGGΨGGΨG CΨGAGCΨΨCG 1600 AACΨGCΨGCA ΨGCCCCΨGCC ACAGΨGΨGCG GCCCΨAAGAA AAGCACCAAΨ 1650 CΨCGΨGAAGA ACAAAΨGCGΨ GAACΨΨCAAC ΨΨCAACGGCC ΨGACCGGCAC 1700 CGGCGΨGCΨG ACAGAGAGCA ACAAGAAGΨΨ CCΨGCCAΨΨC CAGCAGΨΨΨG 1750 GCCGGGAΨAΨ CGCCGAΨACC ACAGACGCCG ΨΨAGAGAΨCC CCAGACACΨG 1800 GAAAΨCCΨGG ACAΨCACCCC ΨΨGCAGCΨΨC GGCGGAGΨGΨ CΨGΨGAΨCAC 1850 CCCΨGGCACC AACACCAGCA AΨCAGGΨGGC AGΨGCΨGΨAC CAGGACGΨGA 1900 ACΨGΨACCGA AGΨGCCCGΨG GCCAΨΨCACG CCGAΨCAGCΨ GACACCΨACA 1950 ΨGGCGGGΨGΨ ACΨCCACCGG CAGCAAΨGΨG ΨΨΨCAGACCA GAGCCGGCΨG 2000 ΨCΨGAΨCGGA GCCGAGCACG ΨGAACAAΨAG CΨACGAGΨGC GACAΨCCCCA 2050 ΨCGGCGCΨGG AAΨCΨGCGCC AGCΨACCAGA CACAGACAAA CAGCCCΨCGG 2100 AGAGCCAGAA GCGΨGGCCAG CCAGAGCAΨC AΨΨGCCΨACA CAAΨGΨCΨCΨ 2150 GGGCGCCGAG AACAGCGΨGG CCΨACΨCCAA CAACΨCΨAΨC GCΨAΨCCCCA 2200 CCAACΨΨCAC CAΨCAGCGΨG ACCACAGAGA ΨCCΨGCCΨGΨ GΨCCAΨGACC 2250 AAGACCAGCG ΨGGACΨGCAC CAΨGΨACAΨC ΨGCGGCGAΨΨ CCACCGAGΨG 2300 CΨCCAACCΨG CΨGCΨGCAGΨ ACGGCAGCΨΨ CΨGCACCCAG CΨGAAΨAGAG 2350 CCCΨGACAGG GAΨCGCCGΨG GAACAGGACA AGAACACCCA AGAGGΨGΨΨC 2400 GCCCAAGΨGA AGCAGAΨCΨA CAAGACCCCΨ CCΨAΨCAAGG ACΨΨCGGCGG 2450 CΨΨCAAΨΨΨC AGCCAGAΨΨC ΨGCCCGAΨCC ΨAGCAAGCCC AGCAAGCGGA 2500 GCΨΨCAΨCGA GGACCΨGCΨG ΨΨCAACAAAG ΨGACACΨGGC CGACGCCGGC 2550 ΨΨCAΨCAAGC AGΨAΨGGCGA ΨΨGΨCΨGGGC GACAΨΨGCCG CCAGGGAΨCΨ 2600 GAΨΨΨGCGCC CAGAAGΨΨΨA ACGGACΨGAC AGΨGCΨGCCΨ CCΨCΨGCΨGA 2650 CCGAΨGAGAΨ GAΨCGCCCAG ΨACACAΨCΨG CCCΨGCΨGGC CGGCACAAΨC 2700 ACAAGCGGCΨ GGACAΨΨΨGG AGCAGGCGCC GCΨCΨGCAGA ΨCCCCΨΨΨGC 2750 ΨAΨGCAGAΨG GCCΨACCGGΨ ΨCAACGGCAΨ CGGAGΨGACC CAGAAΨGΨGC 2800 ΨGΨACGAGAA CCAGAAGCΨG AΨCGCCAACC AGΨΨCAACAG CGCCAΨCGGC 2850 AAGAΨCCAGG ACAGCCΨGAG CAGCACAGCA AGCGCCCΨGG GAAAGCΨGCA 2900 GGACGΨGGΨC AACCAGAAΨG CCCAGGCACΨ GAACACCCΨG GΨCAAGCAGC 2950 ΨGΨCCΨCCAA CΨΨCGGCGCC AΨCAGCΨCΨG ΨGCΨGAACGA ΨAΨCCΨGAGC 3000 AGACΨGGACC CΨCCΨGAGGC CGAGGΨGCAG AΨCGACAGAC ΨGAΨCACAGG 3050 CAGACΨGCAG AGCCΨCCAGA CAΨACGΨGAC CCAGCAGCΨG AΨCAGAGCCG 3100 CCGAGAΨΨAG AGCCΨCΨGCC AAΨCΨGGCCG CCACCAAGAΨ GΨCΨGAGΨGΨ 3150 GΨGCΨGGGCC AGAGCAAGAG AGΨGGACΨΨΨ ΨGCGGCAAGG GCΨACCACCΨ 3200 GAΨGAGCΨΨC CCΨCAGΨCΨG CCCCΨCACGG CGΨGGΨGΨΨΨ CΨGCACGΨGA 3250 CAΨAΨGΨGCC CGCΨCAAGAG AAGAAΨΨΨCA CCACCGCΨCC AGCCAΨCΨGC 3300 CACGACGGCA AAGCCCACΨΨ ΨCCΨAGAGAA GGCGΨGΨΨCG ΨGΨCCAACGG 3350 CACCCAΨΨGG ΨΨCGΨGACAC AGCGGAACΨΨ CΨACGAGCCC CAGAΨCAΨCA 3400 CCACCGACAA CACCΨΨCGΨG ΨCΨGGCAACΨ GCGACGΨCGΨ GAΨCGGCAΨΨ 3450 GΨGAACAAΨA CCGΨGΨACGA CCCΨCΨGCAG CCCGAGCΨGG ACAGCΨΨCAA 3500 AGAGGAACΨG GACAAGΨACΨ ΨΨAAGAACCA CACAAGCCCC GACGΨGGACC 3550 ΨGGGCGAΨAΨ CAGCGGAAΨC AAΨGCCAGCG ΨCGΨGAACAΨ CCAGAAAGAG 3600 AΨCGACCGGC ΨGAACGAGGΨ GGCCAAGAAΨ CΨGAACGAGA GCCΨGAΨCGA 3650 CCΨGCAAGAA CΨGGGGAAGΨ ACGAGCAGΨA CAΨCAAGΨGG CCCΨGGΨACA 3700 ΨCΨGGCΨGGG CΨΨΨAΨCGCC GGACΨGAΨΨG CCAΨCGΨGAΨ GGΨCACAAΨC 3750 AΨGCΨGΨGΨΨ GCAΨGACCAG CΨGCΨGΨAGC ΨGCCΨGAAGG GCΨGΨΨGΨAG 3800 CΨGΨGGCAGC ΨGCΨGCAAGΨ ΨCGACGAGGA CGAΨΨCΨGAG CCCGΨGCΨGA 3850 AGGGCGΨGAA ACΨGCACΨAC ACAΨGAΨGAC ΨCGAGCΨGGΨ ACΨGCAΨGCA 3900 CGCAAΨGCΨA GCΨGCCCCΨΨ ΨCCCGΨCCΨG GGΨACCCCGA GΨCΨCCCCCG 3950 ACCΨCGGGΨC CCAGGΨAΨGC ΨCCCACCΨCC ACCΨGCCCCA CΨCACCACCΨ 4000 CΨGCΨAGΨΨC CAGACACCΨC CCAAGCACGC AGCAAΨGCAG CΨCAAAACGC 4050 ΨΨAGCCΨAGC CACACCCCCA CGGGAAACAG CAGΨGAΨΨAA CCΨΨΨAGCAA 4100 ΨAAACGAAAG ΨΨΨAACΨAAG CΨAΨACΨAAC CCCAGGGΨΨG GΨCAAΨΨΨCG 4150 ΨGCCAGCCAC ACCCΨGGAGC ΨAGCAAAAAA AAAAAAAAAA AAAAAAAAAA 4200 AAAAGCAΨAΨ GACΨAAAAAA AAAAAAAAAA AAAAAAAAAA AAAAAAAAAA 4250 AAAAAAAAAA AAAAAAAAAA AAAAAAAAAA AAAA 4284
¿Hay muchas diferencias entre la secuencia de ARN original codificada en el genoma del coronavirus SARS-CoV-2 y la secuencia del mRNA usada en la fabricación de la vacuna contra la COVID-19 Cominarty, desarrollada por Pfizer/BioNtech? Pues sí, hay muchas diferencias, más de 1000 letras cambiadas (exactamente 1061 ribonucleótidos substituidos). Veamos una comparación y alineamiento entre las secuencias del ARN ORIGINAL (en el genoma ARN del coronavirus SARS-CoV-2) y la de mRNA FINAL (en la vacuna COVID-19 Cominarty) realizada con ayuda de la herramienta bioinformática Clustal Omega, de EMBL-EBI. Cada asterisco denota homología (la misma) secuencia. Los espacios resaltan las diferencias, además de las secuencias nuevas añadidas en las regiones 5′ (al principio) y 3′ (al final). El porcentaje de identidad entre las dos moléculas de ARN, original y final, es del 72,24%.
ORIGINAL ------------------------------------------------------AΨGΨΨΨ 6 FINAL GAGAAΨAAACΨAGΨAΨΨCΨΨCΨGGΨCCCCACAGACΨCAGAGAGAACCCGCCACCAΨGΨΨC 60 ***** ORIGINAL GΨΨΨΨΨCΨΨGΨΨΨΨAΨΨGCCACΨAGΨCΨCΨAGΨCAGΨGΨGΨΨAAΨCΨΨACAACCAGAACΨ 66 FINAL GΨGΨΨCCΨGGΨGCΨGCΨGCCΨCΨGGΨGΨCCAGCCAGΨGΨGΨGAACCΨGACCACCAGAACA 120 ** ** ** ** * **** ** ** ** ** ******** ** ** ** ******** ORIGINAL CAAΨΨACCCCCΨGCAΨACACΨAAΨΨCΨΨΨCACACGΨGGΨGΨΨΨAΨΨACCCΨGACAAAGΨΨ 126 FINAL CAGCΨGCCΨCCAGCCΨACACCAACAGCΨΨΨACCAGAGGCGΨGΨACΨACCCCGACAAGGΨG 180 ** * ** ** ** ***** ** ** ** * ** ** ** ***** ***** ** ORIGINAL ΨΨCAGAΨCCΨCAGΨΨΨΨACAΨΨCAACΨCAGGACΨΨGΨΨCΨΨACCΨΨΨCΨΨΨΨCCAAΨGΨΨ 186 FINAL ΨΨCAGAΨCCAGCGΨGCΨGCACΨCΨACCCAGGACCΨGΨΨCCΨGCCΨΨΨCΨΨCAGCAACGΨG 240 ********* ** * ** ** ** ****** ***** * ******** *** ** ORIGINAL ACΨΨGGΨΨCCAΨGCΨAΨACAΨGΨCΨCΨGGGACCAAΨGGΨACΨAAGAGGΨΨΨGAΨAACCCΨ 246 FINAL ACCΨGGΨΨCCACGCCAΨCCACGΨGΨCCGGCACCAAΨGGCACCAAGAGAΨΨCGACAACCCC 300 ** ******** ** ** ** ** ** ** ******** ** ***** ** ** ***** ORIGINAL GΨCCΨACCAΨΨΨAAΨGAΨGGΨGΨΨΨAΨΨΨΨGCΨΨCCACΨGAGAAGΨCΨAACAΨAAΨAAGA 306 FINAL GΨGCΨGCCCΨΨCAACGACGGGGΨGΨACΨΨΨGCCAGCACCGAGAAGΨCCAACAΨCAΨCAGA 360 ** ** ** ** ** ** ** ** ** ***** *** ******** ***** ** *** ORIGINAL GGCΨGGAΨΨΨΨΨGGΨACΨACΨΨΨAGAΨΨCGAAGACCCAGΨCCCΨACΨΨAΨΨGΨΨAAΨAAC 366 FINAL GGCΨGGAΨCΨΨCGGCACCACACΨGGACAGCAAGACCCAGAGCCΨGCΨGAΨCGΨGAACAAC 420 ******** ** ** ** ** * ** ********* *** ** ** ** ** *** ORIGINAL GCΨACΨAAΨGΨΨGΨΨAΨΨAAAGΨCΨGΨGAAΨΨΨCAAΨΨΨΨGΨAAΨGAΨCCAΨΨΨΨΨGGGΨ 426 FINAL GCCACCAACGΨGGΨCAΨCAAAGΨGΨGCGAGΨΨCCAGΨΨCΨGCAACGACCCCΨΨCCΨGGGC 480 ** ** ** ** ** ** ***** ** ** ** ** ** ** ** ** ** ** **** ORIGINAL GΨΨΨAΨΨACCACAAAAACAACAAAAGΨΨGGAΨGGAAAGΨGAGΨΨCAGAGΨΨΨAΨΨCΨAGΨ 486 FINAL GΨCΨACΨACCACAAGAACAACAAGAGCΨGGAΨGGAAAGCGAGΨΨCCGGGΨGΨACAGCAGC 540 ** ** ******** ******** ** *********** ****** * ** ** ** ORIGINAL GCGAAΨAAΨΨGCACΨΨΨΨGAAΨAΨGΨCΨCΨCAGCCΨΨΨΨCΨΨAΨGGACCΨΨGAAGGAAAA 546 FINAL GCCAACAACΨGCACCΨΨCGAGΨACGΨGΨCCCAGCCΨΨΨCCΨGAΨGGACCΨGGAAGGCAAG 600 ** ** ** ***** ** ** ** ** ** ******** ** ******** ***** ** ORIGINAL CAGGGΨAAΨΨΨCAAAAAΨCΨΨAGGGAAΨΨΨGΨGΨΨΨAAGAAΨAΨΨGAΨGGΨΨAΨΨΨΨAAA 606 FINAL CAGGGCAACΨΨCAAGAACCΨGCGCGAGΨΨCGΨGΨΨΨAAGAACAΨCGACGGCΨACΨΨCAAG 660 ***** ** ***** ** ** * ** ** *********** ** ** ** ** ** ** ORIGINAL AΨAΨAΨΨCΨAAGCACACGCCΨAΨΨAAΨΨΨAGΨGCGΨGAΨCΨCCCΨCAGGGΨΨΨΨΨCGGCΨ 666 FINAL AΨCΨACAGCAAGCACACCCCΨAΨCAACCΨCGΨGCGGGAΨCΨGCCΨCAGGGCΨΨCΨCΨGCΨ 720 ** ** ******** ***** ** * ***** ***** ******** ** ** *** ORIGINAL ΨΨAGAACCAΨΨGGΨAGAΨΨΨGCCAAΨAGGΨAΨΨAACAΨCACΨAGGΨΨΨCAAACΨΨΨACΨΨ 726 FINAL CΨGGAACCCCΨGGΨGGAΨCΨGCCCAΨCGGCAΨCAACAΨCACCCGGΨΨΨCAGACACΨGCΨG 780 * ***** **** *** **** ** ** ** ******** ******* ** * ** ORIGINAL GCΨΨΨACAΨAGAAGΨΨAΨΨΨGACΨCCΨGGΨGAΨΨCΨΨCΨΨCAGGΨΨGGACAGCΨGGΨGCΨ 786 FINAL GCCCΨGCACAGAAGCΨACCΨGACACCΨGGCGAΨAGCAGCAGCGGAΨGGACAGCΨGGΨGCC 840 ** * ** ***** ** **** ***** *** ** ************** ORIGINAL GCAGCΨΨAΨΨAΨGΨGGGΨΨAΨCΨΨCAACCΨAGGACΨΨΨΨCΨAΨΨAAAAΨAΨAAΨGAAAAΨ 846 FINAL GCCGCΨΨACΨAΨGΨGGGCΨACCΨGCAGCCΨAGAACCΨΨCCΨGCΨGAAGΨACAACGAGAAC 900 ** ***** ******** ** ** ** ***** ** ** ** * ** ** ** ** ** ORIGINAL GGAACCAΨΨACAGAΨGCΨGΨAGACΨGΨGCACΨΨGACCCΨCΨCΨCAGAAACAAAGΨGΨACG 906 FINAL GGCACCAΨCACCGACGCCGΨGGAΨΨGΨGCΨCΨGGAΨCCΨCΨGAGCGAGACAAAGΨGCACC 960 ** ***** ** ** ** ** ** ***** ** ** ***** ** ******** ** ORIGINAL ΨΨGAAAΨCCΨΨCACΨGΨAGAAAAAGGAAΨCΨAΨCAAACΨΨCΨAACΨΨΨAGAGΨCCAACCA 966 FINAL CΨGAAGΨCCΨΨCACCGΨGGAAAAGGGCAΨCΨACCAGACCAGCAACΨΨCCGGGΨGCAGCCC 1020 **** ******** ** ***** ** ***** ** ** ***** * ** ** ** ORIGINAL ACAGAAΨCΨAΨΨGΨΨAGAΨΨΨCCΨAAΨAΨΨACAAACΨΨGΨGCCCΨΨΨΨGGΨGAAGΨΨΨΨΨ 1026 FINAL ACCGAAΨCCAΨCGΨGCGGΨΨCCCCAAΨAΨCACCAAΨCΨGΨGCCCCΨΨCGGCGAGGΨGΨΨC 1080 ** ***** ** ** * ** ** ***** ** ** ******* ** ** ** ** ** ORIGINAL AACGCCACCAGAΨΨΨGCAΨCΨGΨΨΨAΨGCΨΨGGAACAGGAAGAGAAΨCAGCAACΨGΨGΨΨ 1086 FINAL AAΨGCCACCAGAΨΨCGCCΨCΨGΨGΨACGCCΨGGAACCGGAAGCGGAΨCAGCAAΨΨGCGΨG 1140 ** *********** ** ***** ** ** ****** ***** * ******** ** ** ORIGINAL GCΨGAΨΨAΨΨCΨGΨCCΨAΨAΨAAΨΨCCGCAΨCAΨΨΨΨCCACΨΨΨΨAAGΨGΨΨAΨGGAGΨG 1146 FINAL GCCGACΨACΨCCGΨGCΨGΨACAACΨCCGCCAGCΨΨCAGCACCΨΨCAAGΨGCΨACGGCGΨG 1200 ** ** ** ** ** ** ** ** ***** ** *** ** ***** ** ** *** ORIGINAL ΨCΨCCΨACΨAAAΨΨAAAΨGAΨCΨCΨGCΨΨΨACΨAAΨGΨCΨAΨGCAGAΨΨCAΨΨΨGΨAAΨΨ 1206 FINAL ΨCCCCΨACCAAGCΨGAACGACCΨGΨGCΨΨCACAAACGΨGΨACGCCGACAGCΨΨCGΨGAΨC 1260 ** ***** ** * ** ** ** ***** ** ** ** ** ** ** ** ** ** ORIGINAL AGAGGΨGAΨGAAGΨCAGACAAAΨCGCΨCCAGGGCAAACΨGGAAAGAΨΨGCΨGAΨΨAΨAAΨ 1266 FINAL CGGGGAGAΨGAAGΨGCGGCAGAΨΨGCCCCΨGGACAGACAGGCAAGAΨCGCCGACΨACAAC 1320 * ** ******** * ** ** ** ** ** ** ** ** ***** ** ** ** ** ORIGINAL ΨAΨAAAΨΨACCAGAΨGAΨΨΨΨACAGGCΨGCGΨΨAΨAGCΨΨGGAAΨΨCΨAACAAΨCΨΨGAΨ 1326 FINAL ΨACAAGCΨGCCCGACGACΨΨCACCGGCΨGΨGΨGAΨΨGCCΨGGAACAGCAACAACCΨGGAC 1380 ** ** * ** ** ** ** ** ***** ** ** ** ***** ***** ** ** ORIGINAL ΨCΨAAGGΨΨGGΨGGΨAAΨΨAΨAAΨΨACCΨGΨAΨAGAΨΨGΨΨΨAGGAAGΨCΨAAΨCΨCAAA 1386 FINAL ΨCCAAAGΨCGGCGGCAACΨACAAΨΨACCΨGΨACCGGCΨGΨΨCCGGAAGΨCCAAΨCΨGAAG 1440 ** ** ** ** ** ** ** *********** * **** ******* ***** ** ORIGINAL CCΨΨΨΨGAGAGAGAΨAΨΨΨCAACΨGAAAΨCΨAΨCAGGCCGGΨAGCACACCΨΨGΨAAΨGGΨ 1446 FINAL CCCΨΨCGAGCGGGACAΨCΨCCACCGAGAΨCΨAΨCAGGCCGGCAGCACCCCΨΨGΨAACGGC 1500 ** ** *** * ** ** ** ** ** ************** ***** ******** ** ORIGINAL GΨΨGAAGGΨΨΨΨAAΨΨGΨΨACΨΨΨCCΨΨΨACAAΨCAΨAΨGGΨΨΨCCAACCCACΨAAΨGGΨ 1506 FINAL GΨGGAAGGCΨΨCAACΨGCΨACΨΨCCCACΨGCAGΨCCΨACGGCΨΨΨCAGCCCACAAAΨGGC 1560 ** ***** ** ** ** ***** ** * ** ** ** ** ** ** ***** ***** ORIGINAL GΨΨGGΨΨACCAACCAΨACAGAGΨAGΨAGΨACΨΨΨCΨΨΨΨGAACΨΨCΨACAΨGCACCAGCA 1566 FINAL GΨGGGCΨAΨCAGCCCΨACAGAGΨGGΨGGΨGCΨGAGCΨΨCGAACΨGCΨGCAΨGCCCCΨGCC 1620 ** ** ** ** ** ******** ** ** ** ** ***** ** ***** ** ** ORIGINAL ACΨGΨΨΨGΨGGACCΨAAAAAGΨCΨACΨAAΨΨΨGGΨΨAAAAACAAAΨGΨGΨCAAΨΨΨCAAC 1626 FINAL ACAGΨGΨGCGGCCCΨAAGAAAAGCACCAAΨCΨCGΨGAAGAACAAAΨGCGΨGAACΨΨCAAC 1680 ** ** ** ** ***** ** ** *** * ** ** ******** ** ** ****** ORIGINAL ΨΨCAAΨGGΨΨΨAACAGGCACAGGΨGΨΨCΨΨACΨGAGΨCΨAACAAAAAGΨΨΨCΨGCCΨΨΨC 1686 FINAL ΨΨCAACGGCCΨGACCGGCACCGGCGΨGCΨGACAGAGAGCAACAAGAAGΨΨCCΨGCCAΨΨC 1740 ***** ** * ** ***** ** ** ** ** *** ***** ***** ***** *** ORIGINAL CAACAAΨΨΨGGCAGAGACAΨΨGCΨGACACΨACΨGAΨGCΨGΨCCGΨGAΨCCACAGACACΨΨ 1746 FINAL CAGCAGΨΨΨGGCCGGGAΨAΨCGCCGAΨACCACAGACGCCGΨΨAGAGAΨCCCCAGACACΨG 1800 ** ** ****** * ** ** ** ** ** ** ** ** ** * ***** ******** ORIGINAL GAGAΨΨCΨΨGACAΨΨACACCAΨGΨΨCΨΨΨΨGGΨGGΨGΨCAGΨGΨΨAΨAACACCAGGAACA 1806 FINAL GAAAΨCCΨGGACAΨCACCCCΨΨGCAGCΨΨCGGCGGAGΨGΨCΨGΨGAΨCACCCCΨGGCACC 1860 ** ** ** ***** ** ** ** ** ** ** ** *** ** ** ** ** ** ORIGINAL AAΨACΨΨCΨAACCAGGΨΨGCΨGΨΨCΨΨΨAΨCAGGAΨGΨΨAACΨGCACAGAAGΨCCCΨGΨΨ 1866 FINAL AACACCAGCAAΨCAGGΨGGCAGΨGCΨGΨACCAGGACGΨGAACΨGΨACCGAAGΨGCCCGΨG 1920 ** ** ** ***** ** ** ** ** ***** ** ***** ** ***** ** ** ORIGINAL GCΨAΨΨCAΨGCAGAΨCAACΨΨACΨCCΨACΨΨGGCGΨGΨΨΨAΨΨCΨACAGGΨΨCΨAAΨGΨΨ 1926 FINAL GCCAΨΨCACGCCGAΨCAGCΨGACACCΨACAΨGGCGGGΨGΨACΨCCACCGGCAGCAAΨGΨG 1980 ** ***** ** ***** ** ** ***** ***** ** ** ** ** ** ***** ORIGINAL ΨΨΨCAAACACGΨGCAGGCΨGΨΨΨAAΨAGGGGCΨGAACAΨGΨCAACAACΨCAΨAΨGAGΨGΨ 1986 FINAL ΨΨΨCAGACCAGAGCCGGCΨGΨCΨGAΨCGGAGCCGAGCACGΨGAACAAΨAGCΨACGAGΨGC 2040 ***** ** * ** ****** * ** ** ** ** ** ** ***** ** ***** ORIGINAL GACAΨACCCAΨΨGGΨGCAGGΨAΨAΨGCGCΨAGΨΨAΨCAGACΨCAGACΨAAΨΨCΨCCΨCGG 2046 FINAL GACAΨCCCCAΨCGGCGCΨGGAAΨCΨGCGCCAGCΨACCAGACACAGACAAACAGCCCΨCGG 2100 ***** ***** ** ** ** ** ***** ** ** ***** ***** ** ****** ORIGINAL CGGGCACGΨAGΨGΨAGCΨAGΨCAAΨCCAΨCAΨΨGCCΨACACΨAΨGΨCACΨΨGGΨGCAGAA 2106 FINAL AGAGCCAGAAGCGΨGGCCAGCCAGAGCAΨCAΨΨGCCΨACACAAΨGΨCΨCΨGGGCGCCGAG 2160 * ** * ** ** ** ** ** *************** ***** ** ** ** ** ORIGINAL AAΨΨCAGΨΨGCΨΨACΨCΨAAΨAACΨCΨAΨΨGCCAΨACCCACAAAΨΨΨΨACΨAΨΨAGΨGΨΨ 2166 FINAL AACAGCGΨGGCCΨACΨCCAACAACΨCΨAΨCGCΨAΨCCCCACCAACΨΨCACCAΨCAGCGΨG 2220 ** ** ** ***** ** ******** ** ** ***** ** ** ** ** ** ** ORIGINAL ACCACAGAAAΨΨCΨACCAGΨGΨCΨAΨGACCAAGACAΨCAGΨAGAΨΨGΨACAAΨGΨACAΨΨ 2226 FINAL ACCACAGAGAΨCCΨGCCΨGΨGΨCCAΨGACCAAGACCAGCGΨGGACΨGCACCAΨGΨACAΨC 2280 ******** ** ** ** ***** *********** ** ** ** ** ******** ORIGINAL ΨGΨGGΨGAΨΨCAACΨGAAΨGCAGCAAΨCΨΨΨΨGΨΨGCAAΨAΨGGCAGΨΨΨΨΨGΨACACAA 2286 FINAL ΨGCGGCGAΨΨCCACCGAGΨGCΨCCAACCΨGCΨGCΨGCAGΨACGGCAGCΨΨCΨGCACCCAG 2340 ** ** ***** ** ** *** *** ** ** **** ** ***** ** ** ** ** ORIGINAL ΨΨAAACCGΨGCΨΨΨAACΨGGAAΨAGCΨGΨΨGAACAAGACAAAAACACCCAAGAAGΨΨΨΨΨ 2346 FINAL CΨGAAΨAGAGCCCΨGACAGGGAΨCGCCGΨGGAACAGGACAAGAACACCCAAGAGGΨGΨΨC 2400 * ** * ** * ** ** ** ** ** ***** ***** *********** ** ** ORIGINAL GCACAAGΨCAAACAAAΨΨΨACAAAACACCACCAAΨΨAAAGAΨΨΨΨGGΨGGΨΨΨΨAAΨΨΨΨ 2406 FINAL GCCCAAGΨGAAGCAGAΨCΨACAAGACCCCΨCCΨAΨCAAGGACΨΨCGGCGGCΨΨCAAΨΨΨC 2460 ** ***** ** ** ** ***** ** ** ** ** ** ** ** ** ** ** ***** ORIGINAL ΨCACAAAΨAΨΨACCAGAΨCCAΨCAAAACCAAGCAAGAGGΨCAΨΨΨAΨΨGAAGAΨCΨACΨΨ 2466 FINAL AGCCAGAΨΨCΨGCCCGAΨCCΨAGCAAGCCCAGCAAGCGGAGCΨΨCAΨCGAGGACCΨGCΨG 2520 ** ** * ** ***** ** ** ****** ** ** ** ** ** ** ** ORIGINAL ΨΨCAACAAAGΨGACACΨΨGCAGAΨGCΨGGCΨΨCAΨCAAACAAΨAΨGGΨGAΨΨGCCΨΨGGΨ 2526 FINAL ΨΨCAACAAAGΨGACACΨGGCCGACGCCGGCΨΨCAΨCAAGCAGΨAΨGGCGAΨΨGΨCΨGGGC 2580 ***************** ** ** ** *********** ** ***** ***** ** ** ORIGINAL GAΨAΨΨGCΨGCΨAGAGACCΨCAΨΨΨGΨGCACAAAAGΨΨΨAACGGCCΨΨACΨGΨΨΨΨGCCA 2586 FINAL GACAΨΨGCCGCCAGGGAΨCΨGAΨΨΨGCGCCCAGAAGΨΨΨAACGGACΨGACAGΨGCΨGCCΨ 2640 ** ***** ** ** ** ** ***** ** ** *********** ** ** ** **** ORIGINAL CCΨΨΨGCΨCACAGAΨGAAAΨGAΨΨGCΨCAAΨACACΨΨCΨGCACΨGΨΨAGCGGGΨACAAΨC 2646 FINAL CCΨCΨGCΨGACCGAΨGAGAΨGAΨCGCCCAGΨACACAΨCΨGCCCΨGCΨGGCCGGCACAAΨC 2700 *** **** ** ***** ***** ** ** ***** ***** *** * ** ** ****** ORIGINAL ACΨΨCΨGGΨΨGGACCΨΨΨGGΨGCAGGΨGCΨGCAΨΨACAAAΨACCAΨΨΨGCΨAΨGCAAAΨG 2706 FINAL ACAAGCGGCΨGGACAΨΨΨGGAGCAGGCGCCGCΨCΨGCAGAΨCCCCΨΨΨGCΨAΨGCAGAΨG 2760 ** ** ***** ***** ***** ** ** * ** ** ** *********** *** ORIGINAL GCΨΨAΨAGGΨΨΨAAΨGGΨAΨΨGGAGΨΨACACAGAAΨGΨΨCΨCΨAΨGAGAACCAAAAAΨΨG 2766 FINAL GCCΨACCGGΨΨCAACGGCAΨCGGAGΨGACCCAGAAΨGΨGCΨGΨACGAGAACCAGAAGCΨG 2820 ** ** **** ** ** ** ***** ** ******** ** ** ******** ** ** ORIGINAL AΨΨGCCAACCAAΨΨΨAAΨAGΨGCΨAΨΨGGCAAAAΨΨCAAGACΨCACΨΨΨCΨΨCCACAGCA 2826 FINAL AΨCGCCAACCAGΨΨCAACAGCGCCAΨCGGCAAGAΨCCAGGACAGCCΨGAGCAGCACAGCA 2880 ** ******** ** ** ** ** ** ***** ** ** *** ** ******* ORIGINAL AGΨGCACΨΨGGAAAACΨΨCAAGAΨGΨGGΨCAACCAAAAΨGCACAAGCΨΨΨAAACACGCΨΨ 2886 FINAL AGCGCCCΨGGGAAAGCΨGCAGGACGΨGGΨCAACCAGAAΨGCCCAGGCACΨGAACACCCΨG 2940 ** ** ** ***** ** ** ** *********** ***** ** ** * ***** ** ORIGINAL GΨΨAAACAACΨΨAGCΨCCAAΨΨΨΨGGΨGCAAΨΨΨCAAGΨGΨΨΨΨAAAΨGAΨAΨCCΨΨΨCA 2946 FINAL GΨCAAGCAGCΨGΨCCΨCCAACΨΨCGGCGCCAΨCAGCΨCΨGΨGCΨGAACGAΨAΨCCΨGAGC 3000 ** ** ** ** ****** ** ** ** ** *** * ** ******** ORIGINAL CGΨCΨΨGACAAAGΨΨGAGGCΨGAAGΨGCAAAΨΨGAΨAGGΨΨGAΨCACAGGCAGACΨΨCAA 3006 FINAL AGACΨGGACCCΨCCΨGAGGCCGAGGΨGCAGAΨCGACAGACΨGAΨCACAGGCAGACΨGCAG 3060 * ** *** ****** ** ***** ** ** ** **************** ** ORIGINAL AGΨΨΨGCAGACAΨAΨGΨGACΨCAACAAΨΨAAΨΨAGAGCΨGCAGAAAΨCAGAGCΨΨCΨGCΨ 3066 FINAL AGCCΨCCAGACAΨACGΨGACCCAGCAGCΨGAΨCAGAGCCGCCGAGAΨΨAGAGCCΨCΨGCC 3120 ** * ******** ***** ** ** * ** ***** ** ** ** ***** ***** ORIGINAL AAΨCΨΨGCΨGCΨACΨAAAAΨGΨCAGAGΨGΨGΨACΨΨGGACAAΨCAAAAAGAGΨΨGAΨΨΨΨ 3126 FINAL AAΨCΨGGCCGCCACCAAGAΨGΨCΨGAGΨGΨGΨGCΨGGGCCAGAGCAAGAGAGΨGGACΨΨΨ 3180 ***** ** ** ** ** ***** ******** ** ** ** ** ***** ** *** ORIGINAL ΨGΨGGAAAGGGCΨAΨCAΨCΨΨAΨGΨCCΨΨCCCΨCAGΨCAGCACCΨCAΨGGΨGΨAGΨCΨΨC 3186 FINAL ΨGCGGCAAGGGCΨACCACCΨGAΨGAGCΨΨCCCΨCAGΨCΨGCCCCΨCACGGCGΨGGΨGΨΨΨ 3240 ** ** ******** ** ** *** ************ ** ***** ** ** ** ** ORIGINAL ΨΨGCAΨGΨGACΨΨAΨGΨCCCΨGCACAAGAAAAGAACΨΨCACAACΨGCΨCCΨGCCAΨΨΨGΨ 3246 FINAL CΨGCACGΨGACAΨAΨGΨGCCCGCΨCAAGAGAAGAAΨΨΨCACCACCGCΨCCAGCCAΨCΨGC 3300 **** ***** ***** ** ** ***** ***** ***** ** ***** ***** ** ORIGINAL CAΨGAΨGGAAAAGCACACΨΨΨCCΨCGΨGAAGGΨGΨCΨΨΨGΨΨΨCAAAΨGGCACACACΨGG 3306 FINAL CACGACGGCAAAGCCCACΨΨΨCCΨAGAGAAGGCGΨGΨΨCGΨGΨCCAACGGCACCCAΨΨGG 3360 ** ** ** ***** ********* * ***** ** ** ** ** ** ***** ** *** ORIGINAL ΨΨΨGΨAACACAAAGGAAΨΨΨΨΨAΨGAACCACAAAΨCAΨΨACΨACAGACAACACAΨΨΨGΨG 3366 FINAL ΨΨCGΨGACACAGCGGAACΨΨCΨACGAGCCCCAGAΨCAΨCACCACCGACAACACCΨΨCGΨG 3420 ** ** ***** **** ** ** ** ** ** ***** ** ** ******** ** *** ORIGINAL ΨCΨGGΨAACΨGΨGAΨGΨΨGΨAAΨAGGAAΨΨGΨCAACAACACAGΨΨΨAΨGAΨCCΨΨΨGCAA 3426 FINAL ΨCΨGGCAACΨGCGACGΨCGΨGAΨCGGCAΨΨGΨGAACAAΨACCGΨGΨACGACCCΨCΨGCAG 3480 ***** ***** ** ** ** ** ** ***** ***** ** ** ** ** *** **** ORIGINAL CCΨGAAΨΨAGACΨCAΨΨCAAGGAGGAGΨΨAGAΨAAAΨAΨΨΨΨAAGAAΨCAΨACAΨCACCA 3486 FINAL CCCGAGCΨGGACAGCΨΨCAAAGAGGAACΨGGACAAGΨACΨΨΨAAGAACCACACAAGCCCC 3540 ** ** * *** ***** ***** * ** ** ** ******** ** *** ** ORIGINAL GAΨGΨΨGAΨΨΨAGGΨGACAΨCΨCΨGGCAΨΨAAΨGCΨΨCAGΨΨGΨAAACAΨΨCAAAAAGAA 3546 FINAL GACGΨGGACCΨGGGCGAΨAΨCAGCGGAAΨCAAΨGCCAGCGΨCGΨGAACAΨCCAGAAAGAG 3600 ** ** ** * ** ** *** ** ** ***** ** ** ***** ** ***** ORIGINAL AΨΨGACCGCCΨCAAΨGAGGΨΨGCCAAGAAΨΨΨAAAΨGAAΨCΨCΨCAΨCGAΨCΨCCAAGAA 3606 FINAL AΨCGACCGGCΨGAACGAGGΨGGCCAAGAAΨCΨGAACGAGAGCCΨGAΨCGACCΨGCAAGAA 3660 ** ***** ** ** ***** ********* * ** ** ** ***** ** ****** ORIGINAL CΨΨGGAAAGΨAΨGAGCAGΨAΨAΨAAAAΨGGCCAΨGGΨACAΨΨΨGGCΨAGGΨΨΨΨAΨAGCΨ 3666 FINAL CΨGGGGAAGΨACGAGCAGΨACAΨCAAGΨGGCCCΨGGΨACAΨCΨGGCΨGGGCΨΨΨAΨCGCC 3720 ** ** ***** ******** ** ** ***** ******** ***** ** ***** ** ORIGINAL GGCΨΨGAΨΨGCCAΨAGΨAAΨGGΨGACAAΨΨAΨGCΨΨΨGCΨGΨAΨGACCAGΨΨGCΨGΨAGΨ 3726 FINAL GGACΨGAΨΨGCCAΨCGΨGAΨGGΨCACAAΨCAΨGCΨGΨGΨΨGCAΨGACCAGCΨGCΨGΨAGC 3780 ** ********** ** ***** ***** ***** ** ** ******** ******** ORIGINAL ΨGΨCΨCAAGGGCΨGΨΨGΨΨCΨΨGΨGGAΨCCΨGCΨGCAAAΨΨΨGAΨGAAGACGACΨCΨGAG 3786 FINAL ΨGCCΨGAAGGGCΨGΨΨGΨAGCΨGΨGGCAGCΨGCΨGCAAGΨΨCGACGAGGACGAΨΨCΨGAG 3840 ** ** ************ ***** ********* ** ** ** ***** ****** ORIGINAL CCAGΨGCΨCAAAGGAGΨCAAAΨΨACAΨΨACACAΨAA------------------------ 3822 FINAL CCCGΨGCΨGAAGGGCGΨGAAACΨGCACΨACACAΨGAΨGACΨCGAGCΨGGΨACΨGCAΨGCA 3900 ** ***** ** ** ** *** * ** ******* * ORIGINAL ------------------------------------------------------------ 3822 FINAL CGCAAΨGCΨAGCΨGCCCCΨΨΨCCCGΨCCΨGGGΨACCCCGAGΨCΨCCCCCGACCΨCGGGΨC 3960 ORIGINAL ------------------------------------------------------------ 3822 FINAL CCAGGΨAΨGCΨCCCACCΨCCACCΨGCCCCACΨCACCACCΨCΨGCΨAGΨΨCCAGACACCΨC 4020 ORIGINAL ------------------------------------------------------------ 3822 FINAL CCAAGCACGCAGCAAΨGCAGCΨCAAAACGCΨΨAGCCΨAGCCACACCCCCACGGGAAACAG 4080 ORIGINAL ------------------------------------------------------------ 3822 FINAL CAGΨGAΨΨAACCΨΨΨAGCAAΨAAACGAAAGΨΨΨAACΨAAGCΨAΨACΨAACCCCAGGGΨΨG 4140 ORIGINAL ------------------------------------------------------------ 3822 FINAL GΨCAAΨΨΨCGΨGCCAGCCACACCCΨGGAGCΨAGCAAAAAAAAAAAAAAAAAAAAAAAAAA 4200 ORIGINAL ------------------------------------------------------------ 3822 FINAL AAAAGCAΨAΨGACΨAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA 4260 ORIGINAL ------------------------ 3822 FINAL AAAAAAAAAAAAAAAAAAAAAAAA 4284
A pesar de la gran cantidad de cambios para estabilizar y optimizar la secuencia del ARN mensajero (mRNA) en cuanto a la proteína codificada solamente hay dos cambios, los indicados K986P y V987P. El resto de cambios son silenciosos, se cambia el codón por uno más optimizado para su traducción en células humanas pero el aminoácido codificado sigue siendo el mismo. Todos los demás aminoácidos codificados son los mismos que los que porta el genoma original del coronavirus, como se puede ver en este alineamiento también realizado con Clustal Omega, de EMBL-EBI, entre la glicoproteína S ORIGINAL y la glicoproteína S FINAL (los asteriscos indican que se mantiene la misma secuencia, los espacios indican diferencias entras las secuencias, solamente aparecen las dos Prolinas -PP- casi al final de la proteína final como diferencias). Utilizo el mismo código de colores descrito anteriormente. Las dos proteínas tienen un porcentaje de identidad del 99.84%.
ORIGINAL MFVFLVLLPLVSSQCVNLTTRTQLPPAYTNSFTRGVYYPDKVFRSSVLHSTQDLFLPFFS 60 FINAL MFVFLVLLPLVSSQCVNLTTRTQLPPAYTNSFTRGVYYPDKVFRSSVLHSTQDLFLPFFS 60 ************************************************************ ORIGINAL NVTWFHAIHVSGTNGTKRFDNPVLPFNDGVYFASTEKSNIIRGWIFGTTLDSKTQSLLIV 120 FINAL NVTWFHAIHVSGTNGTKRFDNPVLPFNDGVYFASTEKSNIIRGWIFGTTLDSKTQSLLIV 120 ************************************************************ ORIGINAL NNATNVVIKVCEFQFCNDPFLGVYYHKNNKSWMESEFRVYSSANNCTFEYVSQPFLMDLE 180 FINAL NNATNVVIKVCEFQFCNDPFLGVYYHKNNKSWMESEFRVYSSANNCTFEYVSQPFLMDLE 180 ************************************************************ ORIGINAL GKQGNFKNLREFVFKNIDGYFKIYSKHTPINLVRDLPQGFSALEPLVDLPIGINITRFQT 240 FINAL GKQGNFKNLREFVFKNIDGYFKIYSKHTPINLVRDLPQGFSALEPLVDLPIGINITRFQT 240 ************************************************************ ORIGINAL LLALHRSYLTPGDSSSGWTAGAAAYYVGYLQPRTFLLKYNENGTITDAVDCALDPLSETK 300 FINAL LLALHRSYLTPGDSSSGWTAGAAAYYVGYLQPRTFLLKYNENGTITDAVDCALDPLSETK 300 ************************************************************ ORIGINAL CTLKSFTVEKGIYQTSNFRVQPTESIVRFPNITNLCPFGEVFNATRFASVYAWNRKRISN 360 FINAL CTLKSFTVEKGIYQTSNFRVQPTESIVRFPNITNLCPFGEVFNATRFASVYAWNRKRISN 360 ************************************************************ ORIGINAL CVADYSVLYNSASFSTFKCYGVSPTKLNDLCFTNVYADSFVIRGDEVRQIAPGQTGKIAD 420 FINAL CVADYSVLYNSASFSTFKCYGVSPTKLNDLCFTNVYADSFVIRGDEVRQIAPGQTGKIAD 420 ************************************************************ ORIGINAL YNYKLPDDFTGCVIAWNSNNLDSKVGGNYNYLYRLFRKSNLKPFERDISTEIYQAGSTPC 480 FINAL YNYKLPDDFTGCVIAWNSNNLDSKVGGNYNYLYRLFRKSNLKPFERDISTEIYQAGSTPC 480 ************************************************************ ORIGINAL NGVEGFNCYFPLQSYGFQPTNGVGYQPYRVVVLSFELLHAPATVCGPKKSTNLVKNKCVN 540 FINAL NGVEGFNCYFPLQSYGFQPTNGVGYQPYRVVVLSFELLHAPATVCGPKKSTNLVKNKCVN 540 ************************************************************ ORIGINAL FNFNGLTGTGVLTESNKKFLPFQQFGRDIADTTDAVRDPQTLEILDITPCSFGGVSVITP 600 FINAL FNFNGLTGTGVLTESNKKFLPFQQFGRDIADTTDAVRDPQTLEILDITPCSFGGVSVITP 600 ************************************************************ ORIGINAL GTNTSNQVAVLYQDVNCTEVPVAIHADQLTPTWRVYSTGSNVFQTRAGCLIGAEHVNNSY 660 FINAL GTNTSNQVAVLYQDVNCTEVPVAIHADQLTPTWRVYSTGSNVFQTRAGCLIGAEHVNNSY 660 ************************************************************ ORIGINAL ECDIPIGAGICASYQTQTNSPRRARSVASQSIIAYTMSLGAENSVAYSNNSIAIPTNFTI 720 FINAL ECDIPIGAGICASYQTQTNSPRRARSVASQSIIAYTMSLGAENSVAYSNNSIAIPTNFTI 720 ************************************************************ ORIGINAL SVTTEILPVSMTKTSVDCTMYICGDSTECSNLLLQYGSFCTQLNRALTGIAVEQDKNTQE 780 FINAL SVTTEILPVSMTKTSVDCTMYICGDSTECSNLLLQYGSFCTQLNRALTGIAVEQDKNTQE 780 ************************************************************ ORIGINAL VFAQVKQIYKTPPIKDFGGFNFSQILPDPSKPSKRSFIEDLLFNKVTLADAGFIKQYGDC 840 FINAL VFAQVKQIYKTPPIKDFGGFNFSQILPDPSKPSKRSFIEDLLFNKVTLADAGFIKQYGDC 840 ************************************************************ ORIGINAL LGDIAARDLICAQKFNGLTVLPPLLTDEMIAQYTSALLAGTITSGWTFGAGAALQIPFAM 900 FINAL LGDIAARDLICAQKFNGLTVLPPLLTDEMIAQYTSALLAGTITSGWTFGAGAALQIPFAM 900 ************************************************************ ORIGINAL QMAYRFNGIGVTQNVLYENQKLIANQFNSAIGKIQDSLSSTASALGKLQDVVNQNAQALN 960 FINAL QMAYRFNGIGVTQNVLYENQKLIANQFNSAIGKIQDSLSSTASALGKLQDVVNQNAQALN 960 ************************************************************ ORIGINAL TLVKQLSSNFGAISSVLNDILSRLDKVEAEVQIDRLITGRLQSLQTYVTQQLIRAAEIRA 1020 FINAL TLVKQLSSNFGAISSVLNDILSRLDPPEAEVQIDRLITGRLQSLQTYVTQQLIRAAEIRA 1020 ************************* ********************************* ORIGINAL SANLAATKMSECVLGQSKRVDFCGKGYHLMSFPQSAPHGVVFLHVTYVPAQEKNFTTAPA 1080 FINAL SANLAATKMSECVLGQSKRVDFCGKGYHLMSFPQSAPHGVVFLHVTYVPAQEKNFTTAPA 1080 ************************************************************ ORIGINAL ICHDGKAHFPREGVFVSNGTHWFVTQRNFYEPQIITTDNTFVSGNCDVVIGIVNNTVYDP 1140 FINAL ICHDGKAHFPREGVFVSNGTHWFVTQRNFYEPQIITTDNTFVSGNCDVVIGIVNNTVYDP 1140 ************************************************************ ORIGINAL LQPELDSFKEELDKYFKNHTSPDVDLGDISGINASVVNIQKEIDRLNEVAKNLNESLIDL 1200 FINAL LQPELDSFKEELDKYFKNHTSPDVDLGDISGINASVVNIQKEIDRLNEVAKNLNESLIDL 1200 ************************************************************ ORIGINAL QELGKYEQYIKWPWYIWLGFIAGLIAIVMVTIMLCCMTSCCSCLKGCCSCGSCCKFDEDD 1260 FINAL QELGKYEQYIKWPWYIWLGFIAGLIAIVMVTIMLCCMTSCCSCLKGCCSCGSCCKFDEDD 1260 ************************************************************ ORIGINAL SEPVLKGVKLHYT 1273 FINAL SEPVLKGVKLHYT 1273 *************
En este otro artículo, publicado hace dos días, también se analiza la secuencia de ARN de la vacuna COVID-19 Cominarty.
Solamente nos queda comentar la mezcla de lípidos que conforman la nanogota que envuelve la molécula de ARN mensajero modificado. El fabricante (Pfizer/BioNtech) habla de LNPs (lipid nanoparticles), nanopartículas lipídicas. Estas LNPs permiten fusionarse con las membranas citoplasmáticas y, a través de la vía endosomal, verter su contenido al interior de la célula, donde el mRNA podrá ser traducido y convertido a la proteína S-mutada (con las dos Prolinas) cuya información genética porta modificada.
Según consta en el Informe de Evaluación de la EMA los componentes lipídicos de estas LNPs son:
- ALC-0315 (4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldecanoate)
- ALC-0159 (2-[(polyethylene glycol)-2000]-N,N-ditetradecylacetamide)
- 1,2-Distearoyl-sn-glycero-3-phosphocholine (DSPC)
- colesterol
y, además, la vacuna final contiene las siguientes sales y componentes básicos: cloruro potásico, fosfato dihidrógeno de potasio, cloruro sódico, fosfato disodio dihidrato, sacarosa y agua, todo ello equilibrado a un pH entre 6.9 y 7.9. Algunos de esos ingredientes lipídicos pueden producir alergia en algunas personas, y por lo tanto, para ellas no estaría indicada la vacunación, como se indica en esta página resumen, a partir de las recomendaciones de la FDA.
Estas LNPs ya habían sido analizadas en estudios pre-clinicos, en animales, y se había verificado que eran adecuadas para administrar y llevar las moléculas de ARN mensajeros con nucleósidos modificados, como describieron Pardi y col. (2015).
Según consta en el Informe de evaluación de la EMA cada persona recibirá una dosis equivalente a 30 microgramos de ARN, encapsuladas en las LNPs en un volumen final inyectable de 0.3 ml por cada una de las dosis. Hay también que recordar que son necesarias dos dosis para llegar al 95% de protección. La segunda dosis se debe administrar 21 días (tres semanas) después de la primera, de acuerdo al informe de la EMA, o como también indican las recomendaciones de la FDA.
Esta vacuna COVID-19 de Pfizer/BioNtech BNT162b2/Cominarty tiene una eficacia del 95% para prevenir la COVID-19 (intervalo de confianza entre 90.3-97.6%). Los ensayos clínicos de fase II/III realizados sobre 36,523 participantes (entre vacunados y placebos) dieron como resultado 8 casos de COVID-19 entre los vacunados y 162 entre los que recibieron placebo, tal y como apareció publicado en la revista NEJM. Inicialmente estas empresas lanzaron dos prototipos de vacunas: BNT162b1 y BNT162b2, con moléculas de ARN mensajero distintas (el primer prototipo portaba informacion genética para un trímero secretable del dominio de unión al receptor, RBD). Sin embargo, tras un estudio piloto, y tras completar los estudios de fase I/II con el primer prototipo BNT162b1, y al observar que las reacciones en personas mayores se observaban en menor cantidad con la segunda versión, se optó por lanzar el ensayo clínico de fase II y fase III solamente con este segundo prototipo; BNT162b2, que finalmente es la que resultó aprobada y es la que será administrada a la población.
Espero que este artículo ayude a comprender la vacuna COVID-19 que nos administrarán durante las próximas semanas o meses. Se trata de una vacuna producto de la ciencia, de mucha ciencia básica (inicialmente desarrollada por muchos grupos, incluidos los investigadores de BioNtech, y luego escalada a nivel global en colaboración con Pfizer) y muchos estudios previos que finalmente en 2020 han servido para completar con rapidez unos ensayos pre-clínicos y clínicos que han demostrado la seguridad y la eficacia de la misma. Por lo tanto, a no ser que pertenezcamos a alguno de los grupos en los cuales la vacunación no está recomendada (p.e. niños menores de 16 años, ser alérgico a alguno de sus componentes, …), lo recomendable, responsable y solidario es vacunarse. Cuando nos toque.
Nota: he grabado un vídeo de divulgación científica de la serie BIOTENTE en el que explico como és la molécula de ARN de esta primera vacuna COVID-19 aprobada en Europa. También referido en una entrada en este blog.
https://montoliu.naukas.com/2020/12/27/la-ciencia-que-hay-detras-de-la-primera-vacuna-contra-la-covid-19/
Soy biólogo e investigador del CSIC en el Centro Nacional de Biotecnología. Me interesa la genética y los aspectos éticos de la investigación científica. Empecé en plantas para saltar luego a ratones y a humanos, donde sigo actualmente. Utilizo modelos animales para entender cómo se establecen las enfermedades raras y qué podemos hacer para curarlas. La edición genética con las herramientas CRISPR nos ha cambiado la vida. Todo lo que podemos hacer, ¿lo deberíamos hacer? Probablemente no. Existen límites éticos en toda investigación. En este blog combino todos estos temas junto a mi pasión divulgadora. Un poco de "gen" y un poco de "ética". Bienvenidos a mi blog sobre "Gen-ética".
Este es el undécimo vídeo de divulgación de la lista BIOTENTE en la que he ido describiendo, de forma sencilla, diferentes conceptos de la genética para poner esta disciplina al alcance de todo el mundo.
https://montoliu.naukas.com/2020/12/30/como-explicar-la-molecula-de-arn-que-contiene-la-primera-vacuna-covid-19-con-piezas-de-tente/
https://www.youtube.com/watch?v=0mKKTLvcETc

No hay comentarios:
Publicar un comentario