Farmacovigilancia y seguridad de las vacunas frente al SARS-CoV-2
La gran mayoría de las vacunas manifiestan sus posibles reacciones
adversas en los primeros meses tras su administración. Una vez que las
vacunas frente a la COVID-19 estén autorizadas, se habrán llevado a cabo
estudios en decenas de miles de personas con varios meses de
seguimiento, que habrán identificado las reacciones adversas frecuentes.
Dado el número elevado de ciudadanos que han participado en los
ensayos clínicos, se estima que han podido identificarse las reacciones
adversas más frecuentes. Pero cuando las vacunas se aprueban, el trabajo
no ha acabado. Al igual que con el resto de medicamentos, las
agencias de medicamentos ponen en marcha sistemas de farmacovigilancia
que permiten identificar reacciones adversas que sean muy poco
frecuentes o que excepcionalmente puedan ocurrir tras un tiempo de haber
recibido la vacuna.
Esta labor de farmacovigilancia en España la realiza la AEMPS de
manera coordinada con las comunidades autónomas, el resto de agencias de
medicamentos nacionales y la Agencia Europea de Medicamentos (EMA, por
sus siglas en inglés). Las agencias de medicamentos de todo el mundo,
incluida la AEMPS, han potenciado estos sistemas para vigilar cualquier
reacción adversa que pueda producirse, compartir, y analizar la
información, y para tomar las medidas que fueran necesarias para
mantener favorable la relación entre sus beneficios y sus riesgos
potenciales.
- https://www.aemps.gob.es/la-aemps/ultima-informacion-de-la-aemps-acerca-del-covid%E2%80%9119/vacunas-contra-la-covid%E2%80%9119/farmacovigilancia-de-vacunas/
3º Informe de Farmacovigilancia sobre Vacunas COVID-19
- Tras la revisión de los datos disponibles, no se ha identificado
ninguna reacción adversa hasta ahora desconocida que pueda ser motivo de
preocupación.
- Hasta el 21 de febrero de 2021, se han administrado en España
3.058.776 dosis de vacunas COVID-19, habiéndose recibido 6.266
notificaciones de acontecimientos adversos. Los acontecimientos más
frecuentemente notificados siguen siendo los trastornos generales
(fiebre, dolor en la zona de vacunación), del sistema nervioso central
(cefalea, mareos) y del sistema musculo-esquelético (mialgia y
artralgia).
- La AEMPS seguirá informando de los acontecimientos notificados y de
cualquier nueva información relevante que pudiera surgir sobre la
seguridad de las vacunas frente a la COVID-19.
Introducción
Hasta el 8 de marzo de 2021, se han autorizado en la Unión Europea
tres vacunas frente a la COVID-19. Al pulsar en el nombre de cada vacuna
se podrá acceder a su ficha técnica.
|
VACUNA
|
LABORATORIO
|
FECHA AUTORIZACIÓN
|
INDICACIONES
|
|
Comirnaty
|
BioNTech/Pfizer
|
22 de diciembre de 2020
|
Inmunización activa para prevenir la COVID-19 causada por el virus SARS-CoV-2, en personas de 16 años de edad y mayores.
|
|
COVID-19 Vaccine Moderna
|
Moderna
|
8 de enero de 2021
|
Inmunización activa para prevenir la COVID-19, causada por el virus SARS-CoV-2, en personas de 18 años de edad y mayores.
|
|
COVID-19 Vaccine AstraZeneca
|
AstraZeneca
|
1 de febrero de 2021
|
Inmunización activa para prevenir la COVID-19 causada por el virus SARS-CoV-2, en personas de 18 años de edad y mayores.
|
El presente informe incluye datos de los acontecimientos adversos
notificados en España tras la administración de vacunas frente a la
COVID-19 hasta el 21 de febrero de 2021. Adicionalmente, también se
incluye información sobre las conclusiones europeas de la evaluación de
los informes de seguridad de la vacuna Moderna y de Comirnaty, así como
las respuestas a nuevas preguntas recibidas y la actualización de
algunas de las previamente publicadas en la web de la AEMPS.
En España se está vacunando siguiendo una estrategia de vacunación
única en todas las CCAA, cuyo contenido se puede consultar en este enlace.
Desde el inicio de la campaña de vacunación en España, el 27 de
diciembre de 2020, hasta el 21 de febrero de 2021, se han administrado
3.058.776 dosis de vacunas frente a la COVID-19.
España, junto con el resto de países de la Unión Europea, coordinados
por la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés),
está realizando una vigilancia estrecha para detectar y evaluar
posibles nuevas reacciones adversas no identificadas durante los ensayos
clínicos de las vacunas frente a la COVID-19.
Datos generales sobre acontecimientos adversos notificados en España tras la vacunación
El Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H), integrado por los Centros Autonómicos de Farmacovigilancia
y coordinado por la Agencia Española de Medicamentos y Productos
Sanitarios (AEMPS), realiza una valoración permanente de los
acontecimientos adversos notificados en España tras la vacunación. Estos
acontecimientos adversos se registran en la base de datos FEDRA y el
objeto de su análisis es identificar posibles nuevas reacciones adversas
que deben someterse a una evaluación más amplia y profunda en la Unión
Europea para tener la confirmación de que están ocasionadas por la
vacuna.
Es esencial tener presente que un acontecimiento adverso es cualquier
problema de salud que ocurre después de la vacunación sin que
necesariamente tenga que estar ocasionado por la vacuna, ya que puede
tratarse de problemas médicos que coinciden en el tiempo o que estén
relacionados con el propio acto de la vacunación.
Los datos que se presentan recogen las notificaciones recibidas en
España de acontecimientos adversos ocurridos tras la vacunación frente a
la COVID-19 y no se pueden considerar reacciones adversas debidas a la
vacuna.
Encontrará más información sobre qué es un acontecimiento adverso y cómo se deben de interpretar estos informes en el siguiente enlace.
Acontecimientos adversos notificados en España hasta el 21 de febrero de 2021 con las vacunas frente a la COVID-19
Hasta el día 21 de febrero de 2021, se han administrado en España
3.058.776 dosis de vacunas frente a la COVID-19, que corresponden a
1.860.403 personas, ya que un 64% recibieron la pauta completa con dos
dosis. El 92% de las dosis administradas correspondieron a Comirnaty, el
4% a la vacuna COVID-19 Vaccine Moderna y el 4% a la vacuna COVID-19
Vaccine AstraZeneca (fuente: Registro de Vacunación, Ministerio de
Sanidad).
Del total de personas vacunadas, un 72% son mujeres. En cuanto a la
distribución por grupos de edad, el 75% corresponde a personas de entre
18 y 64 años y el 25% a mayores de 65 años.
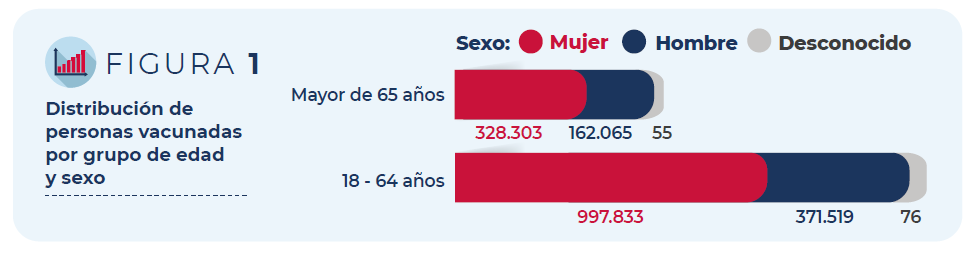
Figura 1: Distribución de personas vacunadas por grupo de edad y sexo
En este periodo se han registrado en la base de datos FEDRA un total
de 6.266 notificaciones de acontecimientos adversos, lo que
correspondería a 205 notificaciones por cada 100.000 dosis
administradas. El 89% han sido comunicadas por profesionales sanitarios,
y el 11% a través del formulario dirigido a ciudadanos. La mayoría de
las notificaciones procedentes de profesionales sanitarios han sido
realizadas por personal médico (46%) o de enfermería (30%). La mayoría
de las notificaciones corresponden a mujeres (83%) y a personas de entre
18 y 64 años (91%). Se han notificado dos casos en lactantes cuyas
madres se habían vacunado con COVID-19 Vaccine Moderna y Comirnaty.

Figura 2: Distribución de las notificaciones de acontecimientos adversos por grupo de edad y sexo
La notificación de acontecimientos adversos no es una herramienta
que pueda utilizarse para calcular la frecuencia de aparición de
reacciones adversas en las personas vacunadas, ya que no es una recogida
sistemática de datos y como se ha mencionado anteriormente, no se trata
de acontecimientos necesariamente relacionados con la vacunación.
Tampoco sirve, por tanto, para realizar comparaciones sobre la seguridad
de las distintas vacunas.
- Para información más detallada pueden acceder al informe dinámico a través del siguiente enlace.
Información sobre cada vacuna
Comirnaty
-
Conclusiones de la evaluación periódica de los datos de farmacovigilancia
El 25 de febrero, el Comité para la Evaluación de Riesgos en
Farmacovigilancia (PRAC, por sus siglas en inglés) de la EMA, evaluó el
segundo informe mensual de seguridad de Comirnaty, así como una revisión
específica sobre reacciones alérgicas graves, concluyendo que el
balance beneficio-riesgo de esta vacuna no se ve modificado.
La evaluación identifica la diarrea y los vómitos como nuevas
reacciones adversas que pueden aparecer tras la administración de
Comirnaty, aunque la frecuencia a la que ocurren se desconoce. La ficha
técnica y el prospecto de esta vacuna se actualizará con esta
información.
Se han evaluado las notificaciones de anafilaxia, reacción adversa ya
conocida, concluyéndose que no es necesario de momento actualizar la
ficha técnica y el prospecto de esta vacuna, que ya contiene información
acerca de su manejo clínico. No obstante, se seguirá vigilando
estrechamente la nueva información de esta reacción adversa.
Los casos con desenlace mortal se analizan mensualmente. La mayoría
ocurrieron en pacientes con diversos tratamientos y enfermedades de base
cuya progresión explica el desenlace, sin que pueda establecerse
relación con la vacuna. En algunos casos, ya se habían iniciado cuidados
paliativos para estos pacientes antes de la vacunación. Estos datos no
identifican ningún aspecto nuevo sobre la seguridad de esta vacuna.
-
Acontecimientos adversos notificados en España hasta el 21 de febrero de 2021
Hasta el día 21 de febrero de 2021, se han administrado 2.808.344
dosis de Comirnaty, que corresponden a 1.631.448 personas, ya que
1.176.896 recibieron la segunda dosis. La mayoría de las personas
vacunadas con Comirnaty son mujeres (72%). En cuanto a la distribución
por grupos de edad, el 72% corresponde a personas de entre 18 y 64 años y
el 28% a mayores de 65 años (fuente: Registro de Vacunación, Ministerio
de Sanidad).
En este periodo se han registrado en FEDRA un total de 5.736
notificaciones de acontecimientos adversos tras recibir Comirnaty, lo
que correspondería a 204 notificaciones por cada 100.000 dosis
administradas.
La mayoría de las notificaciones corresponden a mujeres (83%) y a
personas de entre 18 y 64 años (90%), los grupos que mayoritariamente
han recibido esta vacuna.
Las 5.736 notificaciones incluyen 15.387 términos descriptores de
acontecimientos adversos. Los trastornos generales como fiebre o dolor
en la zona de vacunación siguen siendo los más frecuentemente
notificados, seguidos de los trastornos del sistema nervioso
(mayoritariamente, cefaleas y mareos) y del sistema musculo-esquelético
(principalmente, mialgia y artralgia).
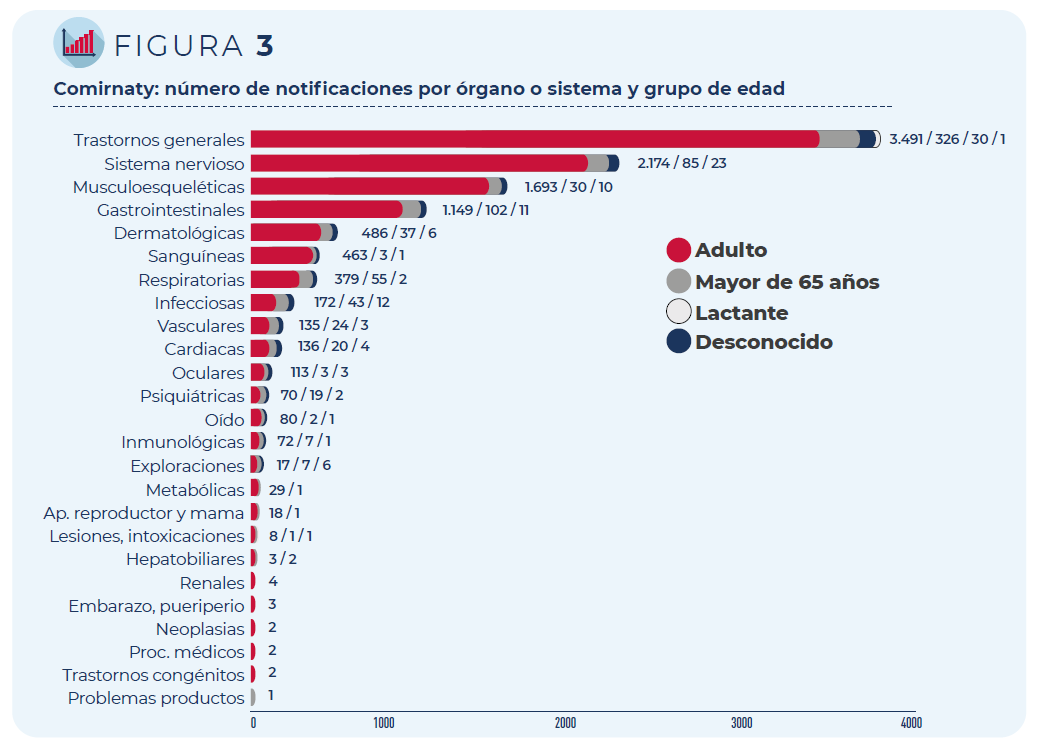
Figura 3. Comirnaty: número de notificaciones por órgano o sistema y grupo de edad
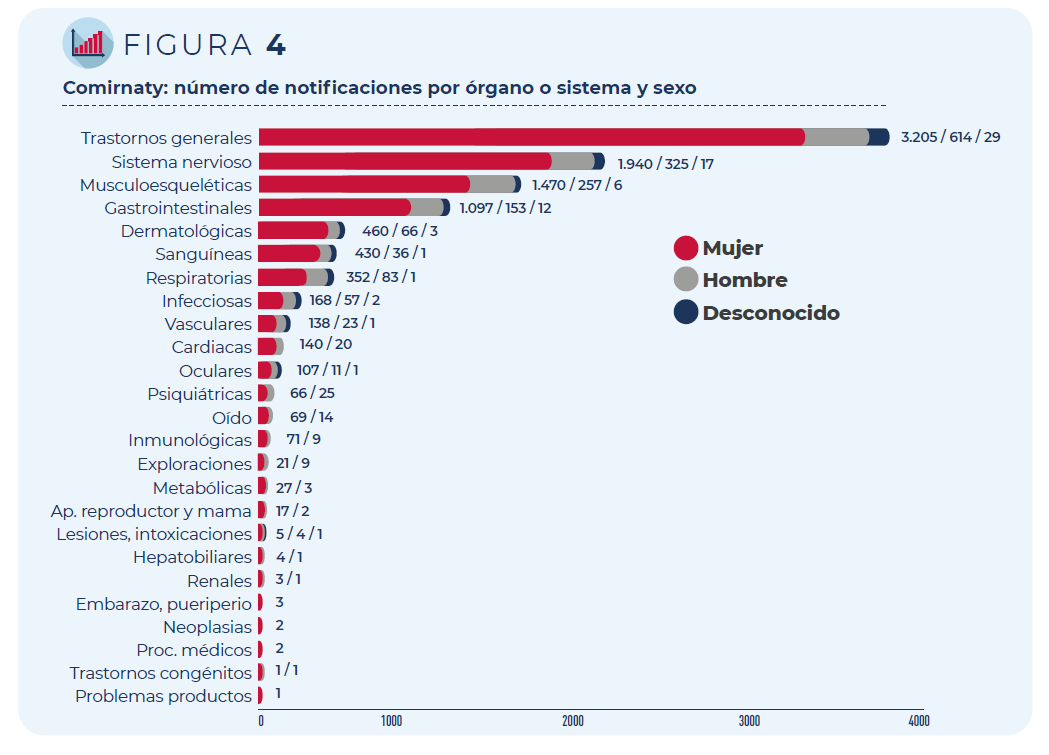
Figura 4. Comirnaty: número de notificaciones por órgano o sistema y sexo
A continuación, se muestran los 10 acontecimientos adversos más
notificados, así como su porcentaje con respecto al número total de
notificaciones registradas (una notificación puede contener más de un
acontecimiento adverso). Todos ellos están ya identificados como
reacciones adversas de Comirnaty y, por tanto, están descritos en la
ficha técnica y el prospecto de esta vacuna. Son acontecimientos
pasajeros que pueden aparecer en los primeros días tras la vacunación.
Tabla 1. Listado de los 10 acontecimientos adversos más notificados con Comirnaty
|
REACCIÓN (PT)
|
Nº DE CASOS
|
PORCENTAJE
|
|
Pirexia
|
2.262
|
39%
|
|
Cefalea
|
1.653
|
29%
|
|
Mialgia
|
1.140
|
20%
|
|
Dolor en la zona de vacunación
|
740
|
13%
|
|
Malestar
|
732
|
13%
|
|
Náuseas
|
554
|
10%
|
|
Escalofríos
|
463
|
8%
|
|
Linfadenopatía
|
435
|
8%
|
|
Artralgia
|
433
|
8%
|
|
Fatiga
|
428
|
7%
|
Los casos de anafilaxia notificados en España han sido objeto de
revisión en los informes anteriores de la AEMPS. La tasa de notificación
se mantiene estable oscilando entre 5-10 casos por millón de dosis
administradas.
COVID-19 Vaccine Moderna
-
Conclusiones de la evaluación periódica de los datos de farmacovigilancia
El 25 de febrero, el PRAC evaluó el primer informe mensual de
seguridad de esta vacuna, concluyendo que su balance beneficio-riesgo no
se ve modificado.
En el mes de enero se notificaron varios casos de reacciones
alérgicas graves (anafilaxia) que ocurrieron en un único centro de
vacunación en San Diego (Estados Unidos). Aunque todos ocurrieron con el
mismo lote de la vacuna, se descartaron problemas de calidad con dicho
lote. Las autoridades estadounidenses analizaron los casos de anafilaxia
recibidos hasta el 10 de enero tras la administración de la primera
dosis de esta vacuna, estimando la tasa notificada en 2,5 casos por
millón de dosis administradas.
La anafilaxia está identificada como una reacción adversa conocida y
como tal se refleja en la ficha técnica y el prospecto. No obstante, se
seguirán vigilando los casos que se notifiquen.
Los acontecimientos adversos con desenlace mortal se analizan
mensualmente. La mayoría ocurrieron en pacientes con diversos
tratamientos y enfermedades de base cuya progresión explica el
desenlace, sin que pueda establecerse relación con la vacuna. En algunos
casos, ya se habían iniciado cuidados paliativos para estos pacientes
antes de la vacunación. Estos datos no identifican ningún aspecto nuevo
sobre la seguridad de esta vacuna.
-
Acontecimientos adversos notificados en España hasta el 21 de febrero de 2021
Hasta el día 21 de febrero de 2021, se administraron un total de
129.602 dosis de COVID-19 Vaccine Moderna, que corresponden a 108.143
personas, ya que 21.459 recibieron la segunda dosis. La mayoría de las
personas vacunadas con COVID-19 Vaccine Moderna fueron mujeres (73%). En
cuanto a la distribución por grupos de edad, el 97% corresponde a
personas de entre 18 y 64 años y el 3% a mayores de 65 años (fuente:
Registro de Vacunación, Ministerio de Sanidad).
En este periodo se han registrado en FEDRA un total de 430
notificaciones de acontecimientos adversos tras la administración de la
vacuna COVID-19 Vaccine Moderna, lo que correspondería a 332
notificaciones por cada 100.000 dosis administradas.
La mayoría de los casos corresponden a mujeres (84%) y a personas de
entre 18 y 64 años (99%), los grupos que mayoritariamente han recibido
esta vacuna.
Las 430 notificaciones incluyen 1.254 términos descriptores de
acontecimientos adversos. Los trastornos generales como fiebre o dolor
en la zona de vacunación han sido los más frecuentemente notificados,
seguidos de los trastornos del sistema nervioso (mayoritariamente,
cefaleas y mareos) y del sistema musculo-esquelético (artralgia y
mialgia).
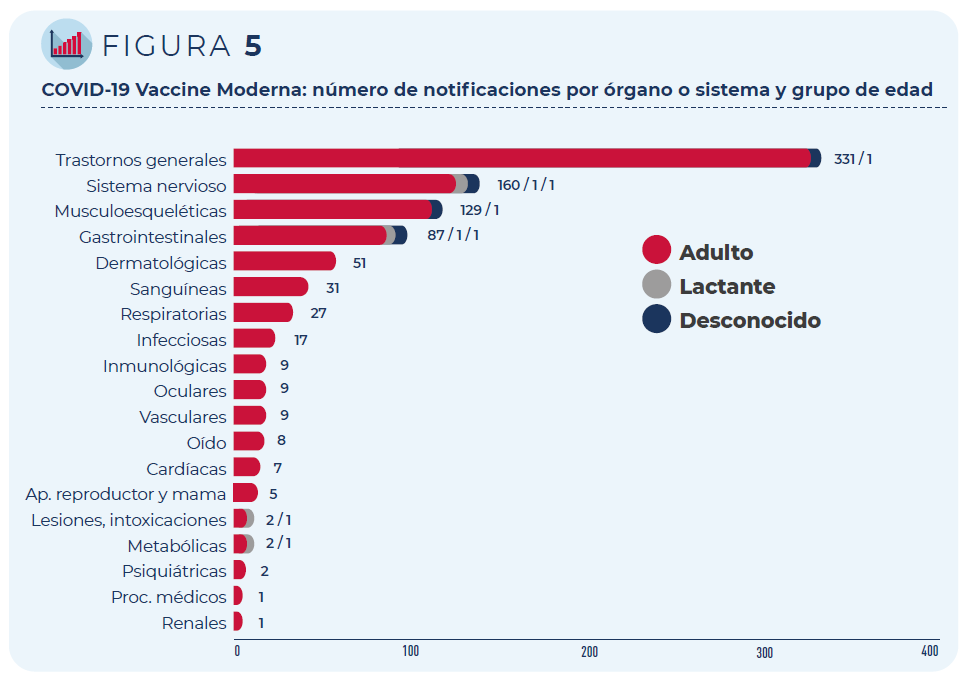
Figura 5: COVID-19 Vaccine Moderna: número de notificaciones por órgano o sistema y grupo de edad
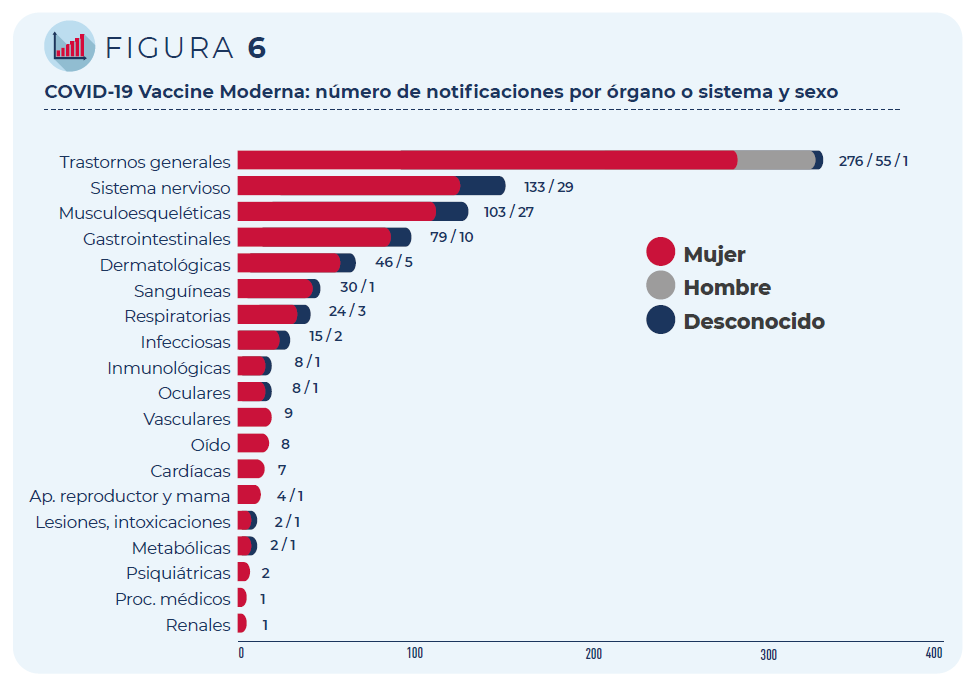
Figura 6: COVID-19 Vaccine Moderna: número de notificaciones por órgano o sistema y sexo
A continuación, se muestran los 10 acontecimientos adversos más
notificados, así como su porcentaje con respecto al número total de
notificaciones registradas (la notificación puede contener más de un
acontecimiento adverso). Todos ellos, salvo malestar y astenia (síntomas
inespecíficos motivados por otros acontecimientos como fiebre),
constituyen reacciones adversas conocidas para esta vacuna y, por tanto,
aparecen ya recogidas en su ficha técnica y prospecto. Son reacciones
pasajeras que pueden ocurrir en los primeros días tras recibir la
vacuna.
Tabla 2. Listado de los 10 acontecimientos adversos más notificados con COVID-19 Vaccine Moderna
|
REACCIÓN (PT)
|
Nº DE CASOS
|
PORCENTAJE
|
|
Pirexia
|
181
|
42%
|
|
Cefalea
|
121
|
28%
|
|
Mialgia
|
73
|
17%
|
|
Dolor en la zona de vacunación
|
67
|
16%
|
|
Náuseas
|
45
|
10%
|
|
Malestar
|
45
|
10%
|
|
Fatiga
|
34
|
8%
|
|
Escalofríos
|
32
|
7%
|
|
Linfadenopatía
|
31
|
7%
|
|
Astenia
|
28
|
7%
|
La anafilaxia es una reacción adversa conocida para esta vacuna, si
bien en estos momentos no es posible calcular su tasa notificada en
España con cierta fiabilidad, debido al limitado número de dosis
administradas hasta el 21 de febrero de 2021.
COVID-19 vaccine AstraZeneca
-
Conclusiones de la evaluación periódica de los datos de farmacovigilancia
Dada su reciente autorización, la evaluación del primer informe de seguridad mensual aún no está disponible.
-
Acontecimientos adversos notificados en España hasta el 21 de febrero de 2021
Hasta el día 21 de febrero de 2021, se administraron un total de
120.830 dosis de COVID-19 Vaccine AstraZeneca. La mayoría de las
personas vacunadas con COVID-19 Vaccine AstraZeneca fueron mujeres (67%)
y todas con edades comprendidas entre los 18 y 64 años (fuente:
Registro de Vacunación, Ministerio de Sanidad).
En este periodo se han registrado en FEDRA un total de 84
notificaciones de acontecimientos adversos con COVID-19 Vaccine
AstraZeneca, lo que correspondería a 69 notificaciones por cada 100.000
dosis administradas.
La mayoría de los casos corresponden a mujeres (87%) y todos ellos se han notificado en personas de entre 18 y 64 años.
Las 84 notificaciones incluyen 267 términos descriptores de
acontecimientos adversos. Los trastornos generales como fiebre o dolor
en la zona de vacunación han sido los más frecuentemente notificados,
seguidos de los trastornos del sistema nervioso (mayoritariamente,
cefaleas y mareos) y del sistema musculo-esquelético (artralgia y
mialgia).
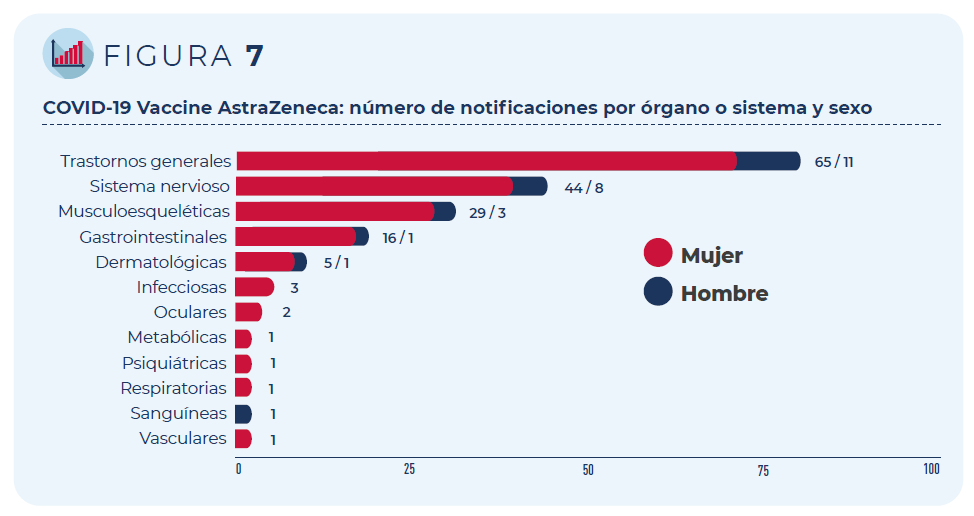
Figura 7: COVID-19 Vaccine AstraZeneca: número de notificaciones por órgano o sistema y sexo
Los 10 acontecimientos adversos más notificados aparecen en la
siguiente tabla, así como su porcentaje con respecto al número total de
notificaciones registradas (la notificación puede contener más de un
acontecimiento adverso). Todos ellos, salvo astenia (síntoma
inespecífico que acompaña a otros acontecimientos), constituyen
reacciones adversas conocidas para esta vacuna y, por tanto, aparecen ya
recogidas en su ficha técnica y prospecto. Son reacciones pasajeras que
pueden ocurrir en los primeros días tras la vacunación.
Tabla 3. Listado de los 10 acontecimientos adversos más notificados con COVID-19 Vaccine AstraZeneca
|
REACCIÓN (PT)
|
Nº DE CASOS
|
PORCENTAJE
|
|
Pirexia
|
69
|
82%
|
|
Cefalea
|
43
|
51%
|
|
Mialgia
|
26
|
31%
|
|
Dolor en la zona de vacunación
|
18
|
21%
|
|
Malestar
|
13
|
15%
|
|
Escalofríos
|
12
|
14%
|
|
Náuseas
|
9
|
11%
|
|
Mareo
|
6
|
7%
|
|
Astenia
|
6
|
7%
|
|
Fatiga
|
6
|
7%
|
- Agradecemos su colaboración notificando los acontecimientos adversos
tras la vacunación frente a la COVID-19. Estas notificaciones, junto
con las registradas en otros países, se analizan para identificar
posibles nuevos riesgos y forman parte de las evaluaciones periódicas
del Comité Europeo para la Evaluación de Riesgos en Farmacovigilancia
(PRAC, por sus siglas en inglés).
- Si tiene que priorizar recuerde que, al igual que con los otros
medicamentos, interesan especialmente los acontecimientos adversos
graves o no conocidos.
- Para más información sobre la notificación de acontecimientos adversos, pulse el siguiente enlace.
Respuestas a preguntas frecuentes sobre seguridad de las vacunas frente a la COVID-19 (nuevas o actualizadas)
Puede consultar todas las respuestas a preguntas frecuentes relacionadas con la seguridad de vacunas frente a la COVID-19 en el siguiente enlace.
- Para recibir próximos Informes de Farmacovigilancia de Vacunas COVID-19, suscríbase aquí.
- https://www.aemps.gob.es/informa/boletines-aemps/boletin-fv/2021-boletin-fv/3o-informe-de-farmacovigilancia-sobre-vacunas-covid-19/
Farmacovigilancia y seguridad de las vacunas frente al SARS-CoV-2
23/12/2020
La gran mayoría de las vacunas manifiestan sus posibles reacciones adversas en los primeros meses tras su administración.
Dado el número elevado de
ciudadanos que han participado en los ensayos clínicos de la vacuna
frente al SARS-CoV-2, se estima que han podido identificarse las
reacciones adversas más frecuentes. Pero al igual que con el resto de
medicamentos, las agencias de medicamentos ponen en marcha sistemas de
farmacovigilancia que permiten identificar reacciones adversas que sean
muy poco frecuentes o que excepcionalmente puedan ocurrir tras un tiempo
de haber recibido la vacuna. (ver Nota Informativa MUH (FV), 18/2020 de la AEMPS de Vigilancia de la seguridad de las vacunas frente a la COVID-19).
La notificación de acontecimientos
adversos que puedan ocurrir tras la vacunación, se lleva a cabo a
través del Sistema Español de Farmacovigilancia de Medicamentos de Uso
Humano (SEFV-H). Los profesionales de la salud y los propios ciudadanos
pueden notificarlos en el formulario electrónico disponible en la web www.notificaRAM.es.
Esta la herramienta más útil para identificar potenciales nuevas
reacciones adversas. Por ello, se recuerda tanto a profesionales
sanitarios y a la ciudadanía la importancia de estas notificaciones. Se
puede consultar más información general sobre ello en este enlace: Notificación de acontecimientos adversos con las vacunas frente a la COVID-19.
| La información sobre la sospecha de reacciones adversas causadas por la vacunación debe quedar registrada en la historia clínica
de la persona vacunada. Así, la vigilancia de la seguridad de estas
vacunas pueda realizarse con la mejor información y además se incorpora a
las bases de datos diseñadas para la seguridad de los medicamentos,
como BIFAP (ver Nota Informativa de la AEMPS MUH (FV), 19/2020 El programa BIFAP en la vigilancia de la seguridad de las vacunas frente a la COVID-19). |
Registro en la Historia Clínica de Sacyl de las reacciones adversas asociadas a la vacuna
A través del Visor Clínico de Medora,
se accede al módulo de vacunas, que es donde se registran las vacunas
administradas a cada paciente con la fecha de cada dosis por cada tipo
de vacuna:

Si se tiene la sospecha de que hay
una reacción adversa asociada a la administración de una vacuna, hay
que clicar sobre la celda con la fecha de administración de la dosis (en
la imagen, la celda verde). Así, se despliega un cuadro con los
detalles de la vacunación. En el apartado de Reacciones, clicando en el
triángulo (en el que aparece el mensaje "agregar reacción adversa") se
puede introducir manualmente una breve descripción de la sospecha de la
reacción adversa. Clicando en el botón de Notificación RAM, se accede a
la página de la AEMPS del sistema español de farmacovigilancia (1).
https://www.saludcastillayleon.es/portalmedicamento/es/noticias-destacados/destacados/farmacovigilancia-seguridad-vacunas-frente-sars-cov-2
Seguridad de las vacunas. Contraindicaciones y precauciones
- Puntos clave
- Introducción
- Evaluación de la seguridad de las vacunas
- Sistemas de monitorización de la seguridad de las vacunas
- Problemas específicos relacionados con la seguridad de las vacunas
- Contraindicaciones y precauciones de las vacunas
- Falsas contraindicaciones
- Bibliografía
- Enlaces de interés
- Historial de actualizaciones
- Tablas y figura incluidas en el capítulo
Tabla 3.1. Tipos de reacciones vacunales
Tabla 3.2. Evaluación
de la seguridad de las vacunas. Fases de los ensayos clínicos con sus
principales objetivos y farmacovigilancia poscomercialización
Tabla 3.3. Puntos clave para la evaluación de la causalidad de un evento adverso relacionado con vacunas
Tabla 3.4. Falsas contraindicaciones y precauciones frente a las vacunas
Figura 3.1. Clasificación de los efectos adversos relacionados con la vacunación
Sugerencia para la citación: Comité
Asesor de Vacunas (CAV-AEP). Seguridad de las vacunas.
Contraindicaciones y precauciones. Manual de vacunas en línea de la AEP
[Internet]. Madrid: AEP; feb/2021. [consultado el dd/mmm/aaaa].
Disponible en: http://vacunasaep.org/documentos/manual/cap-3
⌂
1. Puntos clave
- Las vacunas actuales tienen un satisfactorio perfil de seguridad,
muy por encima del resto de medicamentos. A pesar de ello, cuando se
vacuna a una gran cantidad de población pueden aparecer efectos
adversos, la mayoría de ellos leves y poco frecuentes. Para el control
de los mismos existen en todos los países sistemas de declaración o
notificación de posibles efectos adversos relacionados con la
administración de las vacunas. Es muy importante que el personal
sanitario implicado en la vacunación participe activamente en esta
monitorización.
- Garantizar la seguridad de las vacunas en condiciones reales de uso,
con una estrecha monitorización de su utilización, permite mantener la
confianza en la vacunación y es imprescindible para conseguir una
correcta aceptación de las campañas de vacunación y obtener el máximo
beneficio para toda la población.
- Es imprescindible conocer las contraindicaciones y las precauciones
de las vacunas para minimizar los posibles riesgos de su administración.
- Es necesario saber las falsas contraindicaciones para así evitar las oportunidades perdidas de vacunación.
⌂
2. Introducción
Las vacunas constituyen un apartado especial dentro de los fármacos: a
diferencia de los demás, se administran a personas sanas para evitar
enfermedades y por ello es necesario que las mismas no causen, como
mínimo, más daños de los que podría ocasionar la propia enfermedad; es
decir, el beneficio obtenido debe ser mayor al riesgo de presentar una reacción adversa asociada a su administración. Por ello deben ser lo más seguras posibles.
Las vacunas y, en concreto, los programas de vacunación son una de
las estrategias preventivas más beneficiosas en salud pública.
Las vacunas, como cualquier otro producto biológico o farmacéutico,
no están exentas de reacciones adversas. En su gran mayoría son leves,
bien toleradas y aceptables, aunque en raras ocasiones pueden producirse
efectos de mayor gravedad.
Algunas de las reacciones adversas de las vacunas son tan raras que
solo se aprecian después de una amplia utilización posterior a su
aprobación y comercialización. Por eso es del máximo interés el
seguimiento de los efectos adversos poscomercialización, que permiten
completar el conocimiento sobre su seguridad.
Las vacunas se administran habitualmente a población sana, sobre todo
a niños, y por ello las garantías de seguridad que se les exigen son
máximas. Las consideraciones sobre la seguridad de las vacunas se
evalúan con gran rigor científico y las decisiones sobre su
administración a la población deben basarse en un conocimiento preciso
del cociente beneficio/riesgo de cada vacuna, garantizando que los
beneficios de la vacunación para los individuos y para la comunidad sean
claramente superiores a los riesgos, teniendo en cuenta además la carga
sociosanitaria, la morbilidad y la mortalidad de la enfermedad que se
pretende prevenir.
Las reacciones adversas o eventos adversos son
tan antiguos como los primeros remedios utilizados en el tratamiento de
las enfermedades. Todo producto con actividad farmacológica puede
actuar como tratamiento, pero también como veneno. Ningún producto
biológico o farmacéutico desarrollado hasta ahora es 100 % seguro y 100 %
eficaz.
Se considera evento adverso (EA) a cualquier
incidente médico asociado a la administración de una sustancia
medicamentosa o droga (por ej. una vacuna) de manera temporal, sin que
exista necesariamente una relación causal entre ambos.
Una reacción adversa (RA) medicamentosa es cualquier
efecto nocivo, no deseado y no intencional de una droga, que se
presenta cuando la misma se utiliza a dosis normalmente usadas en los
seres humanos para la profilaxis, diagnóstico, tratamiento de una
enfermedad o para la modificación de una función fisiológica. En este
caso, y a diferencia del evento adverso, existe una posibilidad
razonable de que haya una relación causal entre el fármaco y la
experiencia adversa.
Las vacunas, como sustancias medicamentosas de indicación preventiva o
terapéutica, están incluidas como causa de ambos conceptos.
Los EA incluyen tanto las RA como los efectos adversos derivados de los
errores de administración, los efectos nocivos, la intoxicación
accidental o intencionada o el no cumplimiento de la terapia
farmacológica.
Por tanto, las RA tras la vacunación pueden considerarse un tipo de
EA en el que se sospecha una relación causal entre la administración de
una vacuna y el efecto observado.
A pesar de estas definiciones y a título práctico, utilizaremos el
término reacción adversa para hacer referencia a la clasificación global
de las mismas en el contexto de las vacunas, sin establecer diferencias
semánticas entre evento y reacción.
Las reacciones adversas siguientes a la vacunación pueden
clasificarse, en función de su causa. La OMS las clasifica en cinco
categorías, reflejadas en la tabla 3.1 y en la figura 3.1.
Tabla 3.1. Tipos de reacciones vacunales. (OMS*)
| Tipos de reacciones vacunales |
| a. Reacciones inducidas por la vacunación (incluyendo reacciones
alérgicas). Respuesta individual producida por las propiedades
inherentes al producto, cuando la vacuna ha sido correctamente
manipulada y administrada. |
| b. Reacciones por defectos en la calidad de la vacuna |
| c. Reacciones debidas a errores de programa: errores en el
almacenamiento, manipulación o administración. A diferencia de la
anterior, se puede prevenir y evitar. |
| d. Reacciones debidas a procesos ansiosos relacionados con el acto
vacunal. No relacionadas con el producto, pero sí con el “miedo al acto
vacunal”. Los 4 tipos más frecuentes descritos son: desmayo (síncope),
hiperventilación (mareos, cefalea, hormigueo de manos y boca), vómitos y
convulsiones. |
| e. Eventos coincidentes. No relacionados con la vacuna. |
| f. Reacciones idiosincrásicas o de causa desconocida. |
Figura 3.1. Clasificación de los efectos adversos relacionados con la vacunación. (OMS*)
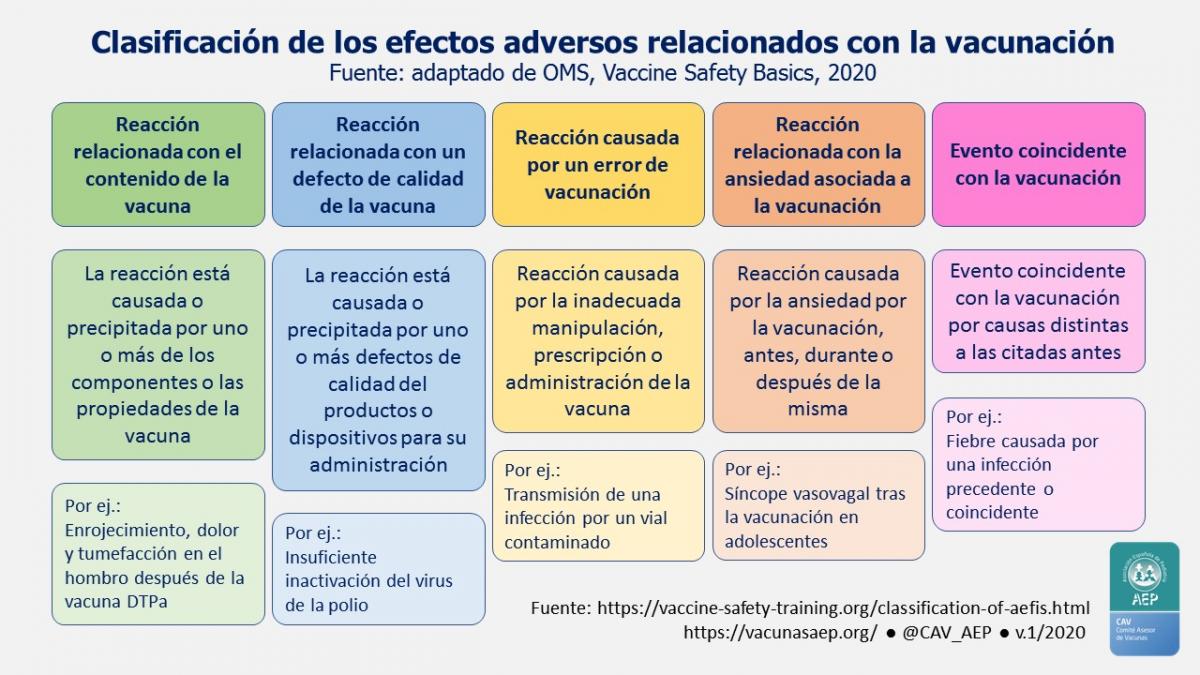
* Modificado de WHO E-learning course on Vaccine Safety Basics.
Es importante conservar y fomentar en la población la confianza en
las vacunas. A lo largo de la historia de la vacunación se han observado
en distintos países (Japón, Reino Unido, Francia, etc.) fenómenos de
pérdida de confianza en la vacunación, relacionados con informaciones
que cuestionaron la seguridad de algunas de ellas (tosferina, sarampión,
hepatitis B) y que llevaron a una disminución de las coberturas de
vacunación. Estas situaciones ocasionaron la reaparición de brotes de
enfermedades inmunoprevenibles, con morbilidad y, en ocasiones, con
mortalidad significativa. En la actualidad, los casos de sarampión han
aumentado sustancialmente en Europa en los últimos años, alcanzando un
número inaceptable de casos y muertes evitables.
Divulgar exhaustivamente entre la población los conocimientos de la
elevada seguridad de las vacunas es tarea necesaria y obligada para
todos los profesionales sanitarios.
⌂
3. Evaluación de la seguridad de las vacunas
La monitorización de la seguridad de las vacunas es uno de los
requerimientos más importantes exigido por las autoridades sanitarias
para otorgar la autorización de su comercialización.
La seguridad de las vacunas se vigila tanto en los estudios
realizados durante el desarrollo de las mismas (precomercialización)
como en la vigilancia continuada tras su comercialización
(poscomercialización). Los estudios poscomercialización son esenciales
para garantizar su seguridad en condiciones reales de uso y permiten,
tras la administración sistemática a un elevado número de personas,
detectar reacciones adversas infrecuentes, potencialmente graves, y
cuantificar su adecuado perfil beneficio/riesgo.
Una de las dificultades para analizar la seguridad de las vacunas es
que no puede medirse directamente, solo puede ser inferida de la
ausencia relativa de sus efectos adversos. Por ese motivo, la vigilancia
de seguridad de cualquier fármaco, incluidas las vacunas, se mantiene
durante todo el tiempo, desde el inicio de su desarrollo y mientras
continúe comercializado.
Estudios precomercialización
Los ensayos clínicos son la primera fuente que aporta los conocimientos de la seguridad de una nueva vacuna.
Los ensayos clínicos, que implican la
participación de seres humanos, están sujetos a una normativa
internacional de calidad científica y ética dirigida al diseño,
realización, registro y redacción de informes de este tipo de estudios,
denominada Guía de Buena Práctica Clínica (GBPC) (ver capítulo:
Investigación en Vacunas). El cumplimiento de esta norma asegura la
protección de los derechos, la seguridad y el bienestar de los
individuos participantes, y garantiza la calidad científica de los datos
obtenidos en un ensayo clínico.
El cumplimiento de las normas de la GBPC garantiza
a su vez la adecuación de la investigación a los principios éticos de
la Declaración de Helsinki de la Asociación Médica Mundial que rigen la
realización de las investigaciones biomédicas en seres humanos y cuyo
escrupuloso cumplimiento permite que dichos estudios sean aceptados por
las autoridades de la mayoría de los países.
En la tabla 3.2
se resumen cuáles son los objetivos a cumplir y el número de pacientes
que es necesario reclutar en cada fase del desarrollo de una vacuna.
En todas las fases del desarrollo clínico de una
nueva vacuna se evalúa, en términos de seguridad, la reactogenicidad y
los problemas que pudieran surgir respecto otras reacciones adversas que
pudieran poner en duda la idoneidad de la vacuna para proseguir su
desarrollo.
Tabla 3.2. Evaluación de la seguridad de las vacunas. Fases
de los ensayos clínicos con sus principales objetivos y
farmacovigilancia poscomercialización.
| Fase |
Número de sujetos1 |
Objetivos prioritarios |
| I |
10-100 |
- Inmunogenicidad
- Seguridad y reactogenicidad
|
| II |
100-1500 |
- Optimización de la dosis
- Pauta posológica
- Seguridad y reactogenicidad
|
| III |
300-60 000 |
- Inmunogenicidad y/o eficacia en población diana
- Seguridad y reactogenicidad
|
| IV (poscomercialización) |
100 a varios miles2 |
- Inmunogenicidad y/o eficacia en otros grupos de población
- Interacción con otras vacunas
- Ampliación de datos de seguridad y reactogenicidad
|
| Vigilancia poscomercialización |
Población general (millones) |
- Efectividad en la población
- Detección de reacciones adversas infrecuentes e inesperadas
|
1 El número de sujetos participantes es orientativo y puede variar en función del tipo de vacuna y la estrategia de desarrollo.
2 Muy variable según los objetivos del estudio.
La aprobación de cualquier vacuna está
condicionada a la comprobación exhaustiva, por parte de estas agencias
reguladoras, de la idoneidad de los estudios realizados, la confirmación
de la obtención de datos de calidad suficientes en el desarrollo
clínico del producto y una evaluación final del cociente
beneficio/riesgo de la nueva vacuna.
Solo para situaciones de emergencia, como la que
se produjo ante la pandemia de gripe A H1N1 en el año 2009, están
establecidos procedimientos de registro acelerado, que acortan los
plazos habituales de evaluación a los que se comprometen las agencias,
establecen la documentación básica exigida sin exclusión de los
requerimientos sobre seguridad y se enfatiza la decisión según una
adecuada evaluación del cociente beneficio/riesgo.
Vigilancia de la seguridad posterior a la aprobación
Es uno de los aspectos de mayor interés tras la
introducción de cualquier producto farmacéutico y, concretamente, de una
herramienta preventiva de aplicación masiva como es la vacunación.
Estos estudios se justifican porque:
- Los ensayos clínicos no tienen poder estadístico suficiente para detectar los posibles efectos adversos muy infrecuentes.
- La necesidad de monitorizar las vacunas tras su
utilización extendida en la población que son excluidos de los ensayos
clínicos: personas con enfermedades crónicas, con determinados
tratamientos farmacológicos, niños prematuros y embarazadas.
- La posibilidad en la práctica diaria de que se administren vacunas fuera del rango de edad recomendado.
⌂
4. Sistemas de monitorización de la seguridad de las vacunas
La modalidad fundamental de monitorización de los efectos secundarios
de las vacunas es el sistema de notificación espontánea (SNE), en el
que todos los profesionales sanitarios, y especialmente los que se
dedican a la administración de vacunas en atención primaria, deben
implicarse:
- Es una herramienta de primera línea para mejorar los conocimientos de la seguridad de las vacunas.
- Todas las reacciones sospechosas que ocurren tras la inmunización se
definen como efectos adversos, lo que no implica necesariamente su
relación causal con la vacuna.
- Las pruebas de causalidad se establecen mediante estudios
epidemiológicos complejos que permiten detectar un riesgo elevado de un
determinado incidente en individuos vacunados en comparación con
individuos no vacunados, especialmente cuando se consigue definir un
periodo de riesgo específico entre la vacunación y el efecto, o cuando
es posible confirmar su plausibilidad biológica.
En EE. UU., el sistema de comunicación espontáneo de efectos adversos
de las vacunas, Vaccine Adverse Event Reporting System (VAERS), está
combinado con dos sistemas de vigilancia activa que se encargan de la
monitorización de la seguridad de las vacunas tras su comercialización:
el Vaccine Safety Datalink (VSD), que es un proyecto colaborativo entre
los Centers for Disease Control and Prevention (CDC) y ocho
organizaciones sanitarias, y el Clinical Immunization Safety Assessment
(CISA), que también es un proyecto colaborativo de seis centros
académicos de EE. UU. El VAERS recibe anualmente más de 13 000
comunicaciones de efectos adversos que son evaluadas con el fin de
confirmar o descartar que exista relación alguna con las vacunas.
En España, los efectos adversos a fármacos, incluidas las vacunas, se
notifican al sistema de farmacovigilancia de la AEMPS mediante las tarjetas amarillas
de declaración voluntaria y espontánea. Cada año se reciben entre
600-800 efectos adversos supuestamente relacionados con la
administración de las vacunas, que son posteriormente evaluados por la
propia agencia y compartidos con otras bases de datos de la EMA y de la
OMS.
La OMS, con el objetivo de velar por el empleo de vacunas de un modo
seguro y eficaz en el mundo y de asegurar que las políticas y las
recomendaciones sobre inmunización son las mejores, utiliza los mejores
datos disponibles, revisa, recopila y publica con regularidad
información referente a la seguridad de todas las vacunas a través de su
Comité Asesor Global sobre Seguridad de las Vacunas (GACVS). El Comité
Consultivo Mundial sobre Inocuidad de las Vacunas (GACVS) propone unas
condiciones necesarias para que un evento adverso pueda ser atribuido a
la vacunación. Cuando se evalúa un evento adverso se deben tener en
cuenta una serie de premisas para poder establecer el mayor grado de
evidencia en la relación con el producto vacunal. Estas premisas o
puntos clave están recogidos en un manual disponible para su consulta en
red, que sirve de guía para la evaluación de la causalidad global a
través de un proceso sistemático y estandarizado y se encuentran
resumidos en la tabla 3.3.
Tabla 3.3. Puntos clave para la evaluación de la causalidad de un evento adverso relacionado con vacunas. (OMS*)
| Puntos clave para la evaluación de la causalidad de un evento adverso relacionado con vacunas |
| 1. Consistencia de resultados (coherencia). La asociación entre un
posible evento adverso y la administración de una vacuna debe ser
constante, es decir que los resultados deben ser reproducibles en
distintos lugares, y puede obtenerse por distintos investigadores.
Diferentes métodos de investigación conducen a las mismas conclusiones. |
| 2. Fuerza de la asociación. La asociación debe ser fuerte en
magnitud (en el sentido epidemiológico), del mismo modo que la relación
dosis-respuesta de la vacuna con los efectos adversos. |
| 3. Especificidad. La asociación debe tener un carácter diferencial;
el evento adverso debe estar vinculado de forma única o específica a la
vacuna en cuestión y no presentarse, con frecuencia, en combinación con
otros estímulos o condiciones externas. |
| 4. Relación temporal. Debe haber una clara relación temporal entre
la administración de la vacuna y el acontecimiento adverso, en el cual
la recepción de la vacuna debe preceder a las primeras manifestaciones
del evento o a la clara exacerbación de una condición existente. Por
ejemplo, una reacción anafiláctica segundos o minutos después de la
inmunización sería fuertemente sugestiva de causalidad. Tras una semana
de la vacunación sería una prueba menos plausible de relación causal. |
| 5. Plausibilidad biológica. La asociación debe ser coherente, es
decir, biológicamente plausible y explicable de acuerdo a los hechos
conocidos en la historia natural y biológica de la enfermedad. |
* Modificado de Causality
assessment of an adverse event following immunization (AEFI): user
manual for the revised WHO classification(Second edition) 2018
Existen otras instituciones independientes que trabajan y revisan
exhaustivamente los datos de seguridad, muy especialmente la Brighton
Collaboration que ha desarrollado un grupo de trabajo multidisciplinar
internacional que, en concordancia con la OMS, los CDC y el European
Centre for Disease Prevention and Control (ECDC), ha establecido
definiciones estandarizadas de los efectos adversos tras la
administración de vacunas. Esta clasificación permite compartir y
comparar datos de seguridad de las vacunas de diferentes procedencias
geográficas entre los profesionales de todo el mundo. La lista completa
de las definiciones de la Brighton Collaboration está disponible en su página web, previo registro, o en otras fuentes,
y su empleo está recomendado por las organizaciones especialmente
implicadas en la evaluación de la seguridad de las vacunas como la OMS,
la FDA y la EMA.
⌂
5. Problemas específicos relacionados con la seguridad de las vacunas
La coincidencia temporal de la aparición de eventos adversos con la
administración de las vacunas ha hecho que a lo largo de los años se
hayan comunicado reacciones o eventos coincidentes. Estudios exhaustivos
no han encontrado, en la mayoría de los casos, una relación de
causalidad que demostrara que ese efecto adverso estuviera realmente
relacionado con la vacuna. A continuación, se muestran diferentes
eventos adversos en los que, tras su investigación, no se ha encontrado
relación causal con estos fármacos.
Tiomersal y neurotoxicidad
Un estudio realizado por el IOM (Instituto de
Medicina), organismo independiente que representa el ámbito sanitario en
la Academia Nacional de Ciencias de EE. UU., planteó la hipótesis de
que el tiomersal podía producir efectos neurotóxicos, especialmente en
prematuros. A pesar de no poder demostrarse esta suposición, en 1999, la
FDA recomendó a los fabricantes de vacunas que adoptaran modificaciones
en el proceso de producción de las mismas, con el objetivo de reducir
la cantidad de tiomersal y si fuera posible sustituirlo.
Desde el año 2002, con la excepción de algunas
vacunas antigripales en sus presentaciones multidosis, las vacunas
infantiles comercializadas en Europa y EE. UU. carecen de tiomersal en
su composición.
Una revisión completa realizada por el IOM en 2004
no halló ninguna evidencia que respalde la asociación entre el
tiomersal contenido en las vacunas y la neurotoxicidad y, concretamente,
su relación con el autismo. Posteriormente, en el año 2011, corroboró
en una nueva actualización de su documento de seguridad la ausencia de
relación entre tiomersal y autismo.
Triple vírica y autismo
Ha sido, y es, una de las cuestiones con mayor
impacto en la opinión pública con relación a la posible neurotoxicidad
de las vacunas, que fue suscitada por el fraudulento estudio original de
Wakefield y cols. en el Reino Unido y publicado en The Lancet en 1998,
en el que se estableció la hipótesis que vinculaba la vacuna triple
vírica con el desarrollo del autismo.
Numerosos estudios controlados y revisiones de
expertos en todo el mundo no han encontrado ninguna evidencia de tal
asociación ni datos que apoyen la plausibilidad biológica de dicha
relación causa-efecto. En febrero de 2010 el comité editorial de The
Lancet se retractaba de la publicación del trabajo de Wakefield, tras
comprobar la falsedad de la información de dicho estudio.
En enero de 2011, la revista British Medical
Journal (BMJ) publica una serie de reportajes que demuestran que
Wakefield manipuló los datos, falseó información y realizó un uso
fraudulento de su estudio.
Un metanálisis publicado en 2014, realizó una
revisión extensa de toda la literatura, incluyendo cinco estudios de
cohortes con 1 256 407 niños y cinco estudios de casos y controles que
incluyeron a 9920 niños. Los datos de los estudios revisados no
revelaron relación entre vacunación y autismo. Además, no encontraron
evidencia entre los componentes de las vacunas (tiomersal o mercurio) o
la vacuna triple vírica (TV) con el desarrollo del autismo o el
trastorno del espectro autista.
Vacunas frente al rotavirus e invaginación intestinal
La primera vacuna frente al rotavirus se
comercializó en EE. UU. por Wyeth-Lederle Vaccines en 1998, con el
nombre de RotaShield. Se incluyó en el calendario de vacunaciones
sistemáticas en EE. UU. en 1999. El sistema de notificación de efectos
adversos de las vacunas VAERS detectó, en tan solo 4 meses, un evento
adverso de dicha vacuna en la que se observaba una posible asociación
entre la misma y casos de invaginación intestinal. La evaluación
combinada mediante el sistema de bases de datos vinculadas sobre
seguridad confirmó un riesgo estadísticamente significativo de
invaginación intestinal en los 7 días tras la administración de la
primera dosis con un riesgo atribuible de un caso adicional de
invaginación por cada 10 000 vacunados.
Esta experiencia estableció un nuevo estándar en
la amplitud de las pruebas de seguridad que las nuevas vacunas frente al
rotavirus deberían superar. El tamaño muestral de los diferentes
estudios de seguridad requería un número superior a 70.000
lactantes para demostrar la ausencia de asociación con las nuevas
vacunas desarrolladas, convirtiéndolos en el paradigma de seguridad
vacunal de los ensayos clínicos.
Estos estudios se realizaron con las dos vacunas
disponibles actualmente, la vacuna recombinante pentavalente
bovina-humana RotaTeq (MSD) y la vacuna monovalente humana Rotarix
(GlaxoSmithKline), comprobando la ausencia de su posible asociación con
la invaginación intestinal.
Datos comunicados de farmacovigilancia activa en Australia tras dos años
de vacunación, no constataron un incremento global de invaginación
intestinal en las cohortes vacunadas, aunque detectaron un posible mayor
riesgo de casos en los 21 días siguientes a la primera dosis con ambas
vacunas. En México se observó también una tasa de casos de invaginación
más alta a la esperada en los 7 días posteriores a la dosis con la
vacuna monovalente.
En EE. UU., país en que la vacunación es
sistemática y se utilizan ambas vacunas, no se detectó un incremento de
casos de invaginación intestinal, con más de 30 millones de dosis
distribuidas de RotaTeq y cerca de 3 millones de dosis de Rotarix. Los
CDC concluyeron que con los estudios de seguimiento en EE. UU. no es
posible excluir un nivel tan bajo de riesgo como el detectado en México,
estimando que si este riesgo existiera representaría a lo sumo un caso
por 100 000 vacunados, siendo el beneficio/riesgo claramente favorable
para la vacunación. Actualmente se considera que este riesgo se cifra en
1 a 5 casos por 100 000 vacunados, sobre todo en los 7 días siguientes
tras la primera dosis.
Vacunas frente al rotavirus y presencia de circovirus porcino
En febrero de 2010, un grupo de investigadores
detectó, con la aplicación de nuevas técnicas de gran sensibilidad, la
presencia de material genético (ADN) de circovirus porcino tipo 1 (PCV1)
en la vacuna Rotarix, y en mayo de 2010 se comprobó también la
presencia de material genético de PCV1 y de circovirus porcino tipo 2
(PCV2) en la vacuna RotaTeq. Los circovirus son pequeños virus ADN que
infectan a animales y no son infecciosos en seres humanos.
Después de una extensa evaluación, los comités de
expertos de la FDA de EE. UU., y la EMA concluyeron de forma unánime que
tanto la presencia de una pequeña cantidad de partículas del virus
PCV-1 en la vacuna Rotarix como de fragmentos de ADN de virus PCV-2 en
la vacuna RotaTeq no afectaba a la seguridad ni a la eficacia de estas
vacunas, no representaban un problema para la salud humana y
establecieron que no existía ninguna razón para limitar el uso de las
mismas. No obstante, ambas compañías establecieron de inmediato nuevos
planes de fabricación para garantizar la producción de vacunas libres de
circovirus, y en la actualidad, ambas vacunas ya no contienen
partículas del virus PCV en su composición.
Vacunas frente al papilomavirus humano y afectación neurológica
En España, en febrero de 2009, se comunicaron dos
casos de adolescentes afectadas por convulsiones no sincopales
relacionadas temporalmente con la administración de Gardasil. Después de
un análisis específico de los casos y de todos los datos de seguridad
en Europa con más de 3 millones de dosis administradas no se pudo
establecer ninguna evidencia de relación causal de estos casos con la
vacuna. La EMA, el 19 de febrero de 2009, concluyó su investigación
confirmando que la vacunación frente al papilomavirus presenta un buen
perfil de seguridad con un beneficio claramente superior al riesgo,
recomendando mantener dicha vacunación en Europa con ambas vacunas y con
las mismas indicaciones.
La OMS, en junio de 2009, revisó todos los datos
mundiales de seguridad de las vacunas frente al papilomavirus, en
concreto tras más de 60 millones de dosis de vacuna tetravalente
administradas en 21 países. El GACVS se reafirmó en el adecuado perfil
de seguridad de esta vacuna y corroboró que el efecto adverso más
frecuente de ésta es su reactogenicidad local y el dolor muscular. Se
comunicaron algunas reacciones alérgicas en pacientes sensibilizados a
alguno de los componentes y se constató un incremento de declaraciones
de síncopes tras la administración de vacunas en adolescentes y jóvenes,
que se consideran debidas a una reacción vagal más frecuente en este
grupo de edad relacionada con la administración por inyección
intramuscular. Este hecho se ratificó, de nuevo, el 12 de marzo de 2014
por el Global Advisory Committee on Vaccine Safety de la OMS.
Un estudio local en EE. UU., en el que se siguió
de forma prospectiva, durante 6 meses, a más de 189 000 mujeres de entre
9 y 26 años, vacunadas con la vacuna VPH-4, no observó ningún tipo de
asociación con la aparición de las 18 principales enfermedades
autoinmunitarias, incluyendo las de tipo neurológico y reumatoide.
Un estudio realizado en Dinamarca y Suecia, con
más de 780 000 niñas y mujeres de entre 10 y 44 años, inmunizadas con
VPH-4, demostró la ausencia de asociación entre el empleo de esta vacuna
y el desarrollo de esclerosis múltiple u otras enfermedades
desmielinizantes.
En Julio de 2017, la OMS, a través del GACVS,
afirmó de manera contundente la extremada seguridad de las vacunas
frente al papiloma humano. Desde la comercialización de estas vacunas en
2006, se han distribuido más de 270 millones de dosis a nivel mundial.
El GACVS ha revisado los datos de seguridad en 2007, y posteriormente en
2008, 2009, 2013, 2014 y 2015. El riesgo de anafilaxia se ha estimado
aproximadamente en 1,7 casos por millón de dosis, y el síncope
relacionado se ha identificado como una reacción de ansiedad o estrés
relacionada con la inyección. No se han identificado otras reacciones
adversas relacionadas con las vacunas. El Comité sigue expresando
preocupación por el hecho de que los eventos adversos no confirmados
tengan un impacto negativo demostrable en la cobertura de la vacuna en
un número creciente de países, y que esto genere un verdadero daño en la
población que puede beneficiarse de la protección demostrada por las
mismas.
Vacunas frente a la gripe pandémica H1N1 2009
Desde el inicio de la pandemia, la OMS coordinó de
forma continuada el intercambio de información sobre la seguridad de
las vacunas utilizadas con las autoridades sanitarias de la mayoría de
los países. El GACVS de la OMS revisó en junio de 2010 los datos de
seguridad de las nuevas vacunas pandémicas frente al virus de la gripe A
H1N1 2009 tras su utilización a escala mundial. Además, de forma
especial, se realizó una vigilancia activa de la posible asociación con
el síndrome de Guillain-Barré y la seguridad en grupos de población
específicos como son las mujeres embarazadas y los pacientes
inmunodeprimidos.
Se han evaluado los datos de seguridad tras la
administración de vacunas inactivadas no adyuvadas, adyuvadas con MF59 y
AS03 y atenuadas a más de 200 millones de personas a nivel mundial. Los
resultados muestran un incremento del riesgo de síndrome de
Guillain-Barré, observándose aproximadamente un caso por 1 000 000 de
dosis, similar al observado con vacunas antigripales estacionales
trivalentes inactivadas no adyuvadas, que hacen que, teniendo en cuenta
que la infección por el virus salvaje también se correlaciona con la
aparición de casos de Guillain-Barré, el beneficio/riesgo de la
vacunación antigripal sea claramente favorable.
No se produjeron reacciones adversas inesperadas y
los datos de seguridad en la administración a mujeres embarazadas
fueron muy tranquilizadores.
En algunos países nórdicos, concretamente en
Finlandia, Suecia e Islandia, se dio a conocer un incremento de casos de
narcolepsia relacionados con la administración de Pandemrix, vacuna
adyuvada con AS03. La EMA comunicó en febrero de 2011 que la evidencia
científica disponible era insuficiente para establecer una relación
causal entre esta vacuna y los casos observados. En 2013 dice que los
informes procedentes de Suecia, Francia y Finlandia coinciden en que los
adultos jóvenes tienen un aumento del riesgo de narcolepsia después de
la vacunación con Pandemrix y reitera la urgencia de continuar la
investigación para identificar los mecanismos biológicos subyacentes de
esta asociación. Lo mismo se apreció en Irlanda y Reino Unido, por lo
que se concluyó que, en personas con predisposición, la vacuna podría
ocasionar narcolepsia.
La conclusión principal del GACVS es que las vacunas pandémicas han presentado un adecuado perfil de seguridad.
Adyuvantes de nueva generación
Las vacunas frente a la gripe estacional
denominadas Fluad/Chiromas (Novartis) y Dotaricin (Alentia BIotech)
están adyuvadas con MF59 (emulsión de aceite en agua), también utilizado
en alguna de las vacunas frente a la gripe pandémica. En un
metaanálisis que evaluó 64 ensayos clínicos con más de 20 000 adultos
vacunados con vacunas antigripales estacionales adyuvadas con MF59, se
observó que estas presentan una mayor tasa de reacciones locales y
sistémicas que las vacunas no adyuvadas en los 3 días siguientes a la
administración de la vacuna. No se observó ningún incremento de
enfermedades autoinmunes asociadas, ni se relacionó con acontecimientos
adversos graves, por lo que se consideró que presentaban un buen perfil
de seguridad. Se comunicaron los resultados de ensayos clínicos con esta
vacuna en niños a partir de los 6 meses de edad con un buen perfil de
seguridad.
El AS04 es un sistema adyuvante que combina sales
de aluminio con MPL (3-O-desa-cil-4'-monofosforil lípido A). Se ha
utilizado en la vacuna frente a la hepatitis B Fendrix
(GlaxoSmithKline), en la vacuna frente al papilomavirus Cervarix
(GlaxoSmithKline) y en una vacuna que no se comercializó frente al
herpes simple tipo II. En un análisis integrado que agrupa los ensayos
clínicos de estas vacunas que contienen AS04 y que incluyeron a más de
68 000 personas, no se detectó ningún incremento significativo en el
grupo vacunado de la incidencia de enfermedades autoinmunes en un
periodo de seguimiento medio de 2 años. Los datos de monitorización
poscomercialización de Cervarix, en los países que la utilizan de forma
sistemática y tras la distribución de más de 16 millones de dosis, no
detectaron problemas de seguridad con esta vacuna ni un incremento de
enfermedades autoinmunes.
Efectos adversos relacionados con la administración
Es muy importante evitar los efectos adversos
relacionados con la administración de las vacunas. Para ello es
imprescindible que el personal sanitario dedicado a la vacunación tenga
un adecuado conocimiento de las técnicas de administración y esté
familiarizado con los preparados vacunales utilizados. Esto es esencial
para evitar errores, fácilmente prevenibles, que pueden comprometer
seriamente la seguridad de la vacunación.
La vacunación, especialmente en adolescentes y
adultos jóvenes, puede asociarse a síncope vasovagal, una pérdida de
conciencia transitoria y del tono postural debidos a un reflejo
simpático anormal, con recuperación espontánea. Según datos del VAERS,
este fenómeno puede producirse en el curso de las 12 horas tras la
administración de una vacuna. En el 45 % de los casos los pacientes
tienen edades entre los 10 y los 19 años y en el 57 % son del sexo
femenino.
Se recomienda un período de vigilancia tras la
administración de vacunas de 15-30 minutos, para la atención inmediata
del paciente tras posibles efectos adversos.
⌂
6. Contraindicaciones y precauciones de las vacunas
En la actualidad existen muy pocas contraindicaciones de las vacunas y
es fundamental conocerlas por parte de todos los profesionales. Es muy
importante diferenciar claramente entre contraindicaciones y
precauciones, ya que las falsas contraindicaciones suponen una
oportunidad de vacunación perdida e incrementan el riesgo de disminuir
las coberturas vacunales.
Además, la contraindicación en la mayoría de las ocasiones está
basada en la estimación del beneficio/riesgo. Por ejemplo, cuando el
beneficio previsible para el sujeto que va a recibir la vacuna es menor
que el riesgo de padecer la enfermedad, o cuando por la edad o por el
estado del paciente se prevea una escasa respuesta inmunológica.
Las precauciones y contraindicaciones, definidas en la ficha técnica
de cada vacuna, pueden cambiar con el tiempo, por lo que deben revisarse
las fichas actualizadas.
El profesional que administra vacunas es responsable de conocer tanto
las contraindicaciones como las precauciones vigentes en el país en el
que ejerce.
Antes de vacunar se comprobará si el paciente tiene contraindicaciones temporales o permanentes para ser vacunado.
Contraindicaciones verdaderas de vacunación
Es una condición del individuo que aumenta de
forma importante el riesgo de padecer un efecto adverso grave si se le
administra una vacuna concreta.
Solo dos situaciones se consideran contraindicaciones permanentes y nunca podrá administrarse la vacuna.
La mayoría de las contraindicaciones son temporales y una vez pasada esa situación el paciente podrá ser vacunado.
Contraindicaciones permanentes
- Una reacción alérgica anafiláctica
a una dosis previa de una vacuna o a algún componente de la misma, es
una contraindicación permanente para volver a administrar dicha vacuna o
cualquier otra vacuna que contenga ese componente.
- -Antecedente de encefalopatía o encefalitis en los 7 días posteriores
a la recepción de una dosis de cualquier vacuna con un componente
antipertúsico, no atribuibles a otra causa, de las que el niño no se
hubiera recuperado completamente en una semana. Si lo hizo, o se
identificó otra causa, no se debe interrumpir ni demorar la aplicación
de la pauta de vacunación frente a la tosferina correspondiente a su
edad. La vacuna Td también está autorizada en menores de 7 años cuando
haya contraindicación para la vacuna de la tosferina.
Contraindicaciones temporales
El embarazo y la inmunodepresión o inmunosupresión
son los dos ejemplos más comunes de contraindicación temporal,
únicamente para las vacunas víricas o bacterianas atenuadas.
Las contraindicaciones temporales permiten la
administración de una vacuna una vez se modifique la situación del
sujeto, y son las siguientes:.
- Embarazo. El embarazo es una
situación que contraindica de forma temporal la administración de
cualquier vacuna atenuada ya sea vírica o bacteriana. Los registros de
mujeres vacunadas inadvertidamente durante el embarazo con triple vírica
o varicela demuestran que no se han producido casos de síndrome de
rubeola congénita ni de varicela congénita, por lo que la administración
inadvertida de estas vacunas durante el embarazo no constituye un
motivo de interrupción del embarazo; además el riesgo en todo caso es
mucho menor que el de la infección natural durante el embarazo. Por otro
lado las vacunas inactivadas se pueden (y algunas se deben) administrar
en el embarazo; como ejemplo la vacuna de la gripe en cualquier
trimestre del embarazo y la vacuna de la tosferina (Tdpa) entre la 27 y
36 semanas de gestación.
- Inmunodepresión. La
inmunodepresión o el tratamiento inmunosupresor contraindican, con
algunas excepciones, las vacunas atenuadas; los niños con niveles de
linfocitos CD4+ superiores al 15 % pueden recibir la vacuna triple
vírica y la de la varicela. Esta inmunodepresión puede condicionar una
respuesta inadecuada de las vacunas inactivadas, que se podrán
administrar, aunque posteriormente es posible que precisen dosis
adicionales. En nuestro país los niños sanos que conviven con personas
inmunodeprimidas pueden y deben recibir todas las vacunas de calendario
que les correspondan por su edad, incluidas las de virus vivos como
triple vírica (sarampión, rubeola o parotiditis), varicela y rotavirus,
asimismo deben vacunarse anualmente frente a la gripe si tienen, al
menos, 6 meses de edad.
- Cualquier enfermedad moderada o grave
(crisis asmática, cardiopatía descompensada, diarrea aguda...), con o
sin fiebre, es una contraindicación temporal para la administración de
las vacunas, salvo situación de riesgo epidémico muy elevado. Una vez
desparecida la situación podrán recibir vacunas.
- La edad de administración puede
considerarse una contraindicación. La vacuna triple vírica no se
aconseja administrarla antes de los 12 meses de vida porque puede
interferir con los anticuerpos maternos y no producir una respuesta
inmunológica completa, aunque en situaciones epidémicas se puede
administrar a partir de los 6 meses de edad, aunque posteriormente
deberá recibir dos dosis a partir de que cumpla los 12 meses de edad.
Igualmente, la vacuna frente a la hepatitis A se administra a partir de
los 12 meses de edad, la antigripal a partir de los 6 meses de edad y
los componentes de carga antigénica estándar de difteria y tosferina (D y
P) solo se pueden aplicar hasta los 7 años de edad.
Precauciones o limitaciones para la vacunación
Son situaciones en las que la administración de
una vacuna condiciona un mayor riesgo de presentar un efecto adverso o
bien que la respuesta inmunitaria a la vacuna pueda ser insuficiente y
no permita obtener una adecuada protección.
Una precaución indica que debe valorarse el
cociente riesgo/beneficio antes de decidir la administración de la
vacuna en cuestión. En determinadas circunstancias en las que el
beneficio es superior al riesgo (p. e. situación de epidemia), la vacuna
puede administrarse.
Algunas situaciones consideradas precauciones son:
- Encefalopatía progresiva, epilepsia refractaria
al tratamiento farmacológico u otro trastorno neurológico no
estacionario de causa desconocida En estos casos se recomienda retrasar
la vacunación frente a la tosferina hasta la estabilización del proceso.
Si a juicio del médico responsable no es esperable una evolución hacia
su estabilización en un período de tiempo razonable, dada la ausencia de
evidencias que apoyen la relación entre la vacuna de la tosferina
acelular y la generación de un daño neurológico añadido, debería
plantearse la opción de vacunar con preparados que contengan antígenos
de B. pertussis, por presentar un balance riesgo/beneficio favorable.
En este sentido, ante encefalopatías epilépticas inestables del
lactante no vinculadas patológicamente a la vacunación, como los
síndromes de West y de Dravet, debe abogarse por no interrumpir ni
demorar la recepción de las vacunas acelulares de la tosferina de
acuerdo con sus indicaciones sistemáticas.. - Historia de síndrome de Guillain-Barré en las 6
semanas posteriores a la administración de una vacuna. En este caso
deberá valorarse con precaución la conveniencia o no de administrar una
dosis posterior de dicha vacuna.
- Historia de reacciones de hipersensibilidad de
tipo Arthus después de una dosis previa de una vacuna que contiene
toxoide diftérico o toxoide tetánico. En este caso se debe postergar la
vacunación hasta que hayan transcurrido, al menos, 10 años desde la
última dosis de vacuna que contenga estos toxoides.
- Pacientes con enfermedades crónicas y/o
inmunodepresión: la respuesta a la vacunación puede ser subóptima en
algunos de estos pacientes, por lo que las vacunas deben administrarse
atendiendo a este hecho. Se ha comentado previamente que en caso de
inmunodepresión las vacunas atenuadas están contraindicadas en la
mayoría de las situaciones.
- La administración de productos biológicos
(inmunoglobulinas o sangre) antes de la administración de la vacuna
triple vírica o la de la varicela (ver capítulo 43).
- Una excepción a la anafilaxia como
contraindicación son los niños con alergia anafiláctica al huevo, ya que
pueden recibir la vacuna triple vírica en el centro de salud, porque
prácticamente no tiene proteínas de huevo, esperando posteriormente
15-30 minutos en la sala de espera como con todas las vacunas y
actualmente, también, pueden recibir vacunas inactivadas frente a la
gripe en el centro de salud.
La cirugía y la anestesia no
presentan interacciones e interferencias con las vacunaciones, en
general. Aunque en algunas ocasiones es conveniente tener en cuenta
ciertas precauciones para alcanzar el máximo beneficio de las
vacunaciones (por ejemplo en la esplenectomía programada y el trasplante
de órganos), y acomodar las agendas de la intervención y las
vacunaciones para evitar la coincidencia de la posible reacción vacunal
con la hospitalización y la intervención. Aparte de las circunstancias
especiales citadas, en los casos en los que estén indicadas una
intervención quirúrgica o diagnóstica con anestesia y alguna vacunación,
se pueden programar de la siguiente forma:
- Vacunaciones antes: 5-7 días antes en el caso de vacunas inactivadas y 14 días en el de las atenuadas.
- Vacunaciones después: 1-2 semanas, según la recuperación clínica del paciente.
⌂
7. Falsas contraindicaciones
Es muy importante conocer cuáles son las falsas
contraindicaciones de las vacunas, para evitar oportunidades perdidas;
porque no solamente conllevan retrasos innecesarios para la adecuada
protección, sino que además favorecen la propagación en la sociedad de
creencias erróneas con relación a las situaciones en las que se puede o
no se puede vacunar.
Existe una larga lista de circunstancias
consideradas contraindicaciones sin serlo. Entre las más frecuentes
destacan las mostradas en la tabla 3.4.
Tabla 3.4.- Falsas contraindicaciones y precauciones frente a las vacunas.
|
Vacuna
|
Circunstancias habitualmente percibidas de forma errónea como contraindicación o precaución
|
|
En general, para todas las vacunas,
incluyendo DTPa, Td, Tdpa, SRP, Hib,
hepatitis A, hepatitis B, varicela, rotavirus,
VNC, antigripal inactivada, VNP23, Polio, Men·ACWY y VPH
|
- Enfermedad aguda leve, con o sin fiebre
- Reacción local leve o moderada (es decir, hinchazón, enrojecimiento, dolor)
- Fiebre baja o moderada después de la dosis anterior
- Ausencia de examen físico previo, en persona con apariencia sana
- Terapia antimicrobiana actual (a)
- Fase de enfermedad convaleciente
- Prematuridad
- Exposición reciente a una enfermedad infecciosa
- Historia de alergia a la penicilina, otras alergias no causadas por
la vacuna o a componentes no incluidos en la vacuna, familiares con
alergias o estar recibiendo inmunoterapia con extractos de alérgenos,
solo se tendrá la precaución de aplicarlos en miembros distintos
- Historia de síndrome de Guillain-Barré (b)
- Historia familiar de efectos adversos tras las vacunas
- Antecedentes de convulsiones febriles o epilepsia estable
- Haber padecido la enfermedad para la que se vacuna, ya que en todo
caso incrementará la inmunidad frente a ella. (p. ej., tosferina)
- Tratamiento con corticoides tópicos o inhalados o con dosis fisiológicas de reemplazo con corticoides sistémicos
- Antecedentes de asma, eccema o atopia
- Antecedentes de síndrome pertusoide, sarampión, rubeola, parotiditis, varicela, herpes zóster o enfermedad meningocócica
- Patologías diversas: parálisis cerebral, síndrome de Down,
ictericia neonatal, bajo peso al nacer, cirugía reciente (si cirugía
mayor, demorar las vacunas 2 semanas tras la intervención, valorando
siempre el beneficio/riesgo) o inminente (salvo vacunas de virus
atenuados en las 4 semanas previas a un trasplante de órgano sólido)
- Lactancia materna (tanto en lo que se refiere a la madre como al
lactante), salvo en el caso de la vacunación materna contra la fiebre
amarilla (ver capítulo 24)
y precaución en el caso de la vacunación materna frente a la varicela
por si apareciera reacción exantemática local o general a la vacuna, en
cuyo caso, por precaución, la madre no contactará con el lactante
- Contacto domiciliario con personas inmunodeficientes (con la excepción de la vacuna antipoliomielítica oral)
- Contacto con enfermedad infecciosa
- Registros vacunales previos no conocidos
- Hospitalización: el niño hospitalizado puede recibir las vacunas
que precise en las unidades neonatales hospitalarias, incluida la vacuna
frente al rotavirus, según las recomendaciones actuales
|
|
DTPa
|
- Historia de fiebre de ≥40,5 °C durante <48 horas después de la vacunación con una dosis previa de DTP/DTPa/Tdpa
- Colapso o estado parecido a un shock (episodio de
hipotonía-hiporrespuesta) dentro de las 48 horas tras recibir una dosis
de DTP/DTPa/Tdpa
- Convulsión ≤3 días después de recibir una dosis de DTP/DTPa/Tdpa
- Llanto persistente e inconsolable que dura ≥3 horas dentro de las 48 horas después de recibir una dosis de DTP/DTPa/Tdpa
- Antecedentes familiares de convulsiones
- Antecedentes familiares de síndrome de muerte súbita del lactante
- Antecedentes familiares de un evento adverso después de la administración de DTP/DTPa/Tdpa
- Condiciones neurológicas estables (p. ej., parálisis cerebral,
epilepsia bien controlada o retraso en el desarrollo neurológico)
|
|
Gripe atenuada
(intranasal)
|
- Profesionales sanitarios que atienden a pacientes con enfermedades
crónicas o inmunodeprimidos (una excepción son los que atienden a
pacientes con inmunodepresión grave que requieren atención en un entorno
protegido)
- Amamantamiento
- Contactos de personas con enfermedades crónicas o inmunodeprimidos
(una excepción son los contactos de pacientes gravemente
inmunodeprimidos que requieren atención en un entorno protegido)
|
|
Gripe inactivada
(inyectable)
|
- Alergia no grave (p. ej., por contacto) al látex o al tiomersal
- Alergia anafiláctica al huevo
- Administración concurrente de warfarina o aminofilina
|
|
Hepatitis B
|
- Embarazo
- Enfermedad autoinmune (p. ej., lupus eritematoso sistémico o artritis reumatoide)
- Inmunosupresión
|
|
Neumococo polisacarídica (VNP23)
|
- Historia de enfermedad neumocócica invasora o neumonía
|
|
Polio inactivada
|
- Administración previa de ≥1 dosis de vacuna atenuada oral frente a la polio
|
|
Rotavirus
|
- Prematuridad
- Contactos domésticos inmunodeprimidos
- Contactos embarazadas en el hogar
|
|
SRP (triple vírica)
(c) (d)
|
- Prueba cutánea de la tuberculina positiva
- Prueba simultánea de tuberculina en la piel o ensayo de liberación de interferón gamma (IGRA) (e)
- Amamantamiento
- Embarazo de la madre del receptor u otro contacto cercano o familiar
- Mujer en edad fértil
- Contacto familiar o familiar inmunodeficiente
- Infección por VIH asintomática o levemente sintomática
- Alergia al huevo de cualquier tipo, incluida la anafiláctica
|
|
Tdpa
|
- Historia de fiebre de ≥40,5 °C durante <48 horas después de la vacunación con una dosis previa de DTP/DTPa/Tdpa
- Historia de colapso o estado de shock (es decir, episodio de
hipotonía hiporrespuesta) dentro de las 48 horas posteriores a la
administración de una dosis previa de DTP/DTPa/Tdpa
- Antecedentes de convulsión <3 días después de recibir una dosis previa de DTP/DTPa/Tdpa
- Antecedentes de llanto persistente e inconsolable que dura más de 3
horas, dentro de las 48 horas después de recibir una dosis previa de
DTP/DTPa/Tdpa
- Historial de hinchazón extensa de las extremidades después de
DTP/DTPa/Tdpa/Td que no se trate de una reacción de tipo Arthus
- Historia de trastorno neurológico estable
- Historia de neuritis braquial
- Alergia al látex no anafiláctica
- Amamantamiento
- Inmunosupresión
|
|
Varicela
|
- Embarazo de la madre del receptor u otro contacto cercano o familiar
- Contacto familiar o familiar inmunodeficiente (f)
- Infección por VIH asintomática o levemente sintomática
- Inmunodeficiencia humoral (p. ej., agammaglobulinemia)
|
|
Virus Papiloma Humano
|
- Prueba previa de Papanicolaou alterada
- Infección conocida por VPH
- Amamantamiento
- Historia de verrugas genitales
|
Abreviaturas: DTP
= toxoide diftérico, toxoide tetánico y tosferina de células enteras;
DTPa = toxoides tetánico y diftérico y tosferina acelular de carga
estándar; Hib = Haemophilus influenzae tipo b; Men·ACWY
= vacuna tetravalente conjugada meningocócica; SRP = sarampión, rubeola
y paperas; Td = toxoides tetánico y diftérico de carga reducida; Tdpa =
toxoide tetánico, toxoide diftérico reducido y tosferina acelular de
carga reducida; VIH = virus de la inmunodeficiencia humana; VNC = vacuna
antineumocócica conjugada; VNP23 = vacuna polisacárida neumocócica de
23 serotipos; VPH = virus del papiloma humano; VPI = poliovirus
inactivado.
(a)
Los antibióticos podrían interferir con la vacuna tifoidea oral Ty21a y
ciertos medicamentos antivirales pueden interferir con las vacunas que
contienen el componente varicela.
(b) Una excepción es el síndrome de Guillain-Barré
dentro de las 6 semanas siguientes a una dosis de vacuna frente a la
gripe o de vacuna que contiene toxoide tetánico, que son precauciones
para las vacunas frente a la gripe y las vacunas que contienen toxoide
tetánico, respectivamente.
(c) Las vacunas TV y varicela se pueden administrar el
mismo día. Si no se administran el mismo día, estas vacunas deben
separarse por, al menos, 28 días.
(d) Los niños infectados por el VIH deben recibir
inmunoglobulina después de la exposición al sarampión. Los niños
infectados por el VIH pueden recibir la vacuna contra la varicela y el
sarampión si el recuento de linfocitos T CD4+ es >15 %.
(e) La vacunación contra el sarampión podría suprimir
temporalmente la reactividad de la tuberculina. La vacuna que contiene
el sarampión se puede administrar el mismo día que la prueba de la
tuberculina o IGRA. Si las pruebas no pueden realizarse hasta después
del día de la vacunación TV, la prueba debe posponerse durante, al
menos, 4 semanas después de la vacunación. Si existe una necesidad
urgente de realizar una prueba cutánea o IGRA, hágalo con el
entendimiento de que la vacuna puede reducir la reactividad.
(f) Si un vacunado experimenta una erupción
supuestamente relacionada con la vacuna 7-25 días después de la
vacunación, la persona debe evitar el contacto con personas
inmunocomprometidas durante la erupción.
Fuente: Modificado
de Advisory Committee on Immunization Practices (ACIP).
Contraindications and Precautions. Vaccine Recommendations and
Guidelines of the ACIP: General Best Practice Guidelines for Immunization (2018).
⌂
8. Bibliografía
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Vacunación de niños en los que no está indicada la vacuna frente a la tosferina. 3 de abril de 2009. Disponible en:
- Andrews N, Stowe J, Miller E. No increased risk of Guillain-Barré
syndrome after human papilloma virus vaccine: A self-controlled
case-series study in England. Vaccine. 2017;35:1729–32.
- Asturias EJ, Wharton M, Pless R, MacDonald NE, Chen RT, Andrews N,
et al. Contributions and challenges for worldwide vaccine safety: The
Global Advisory Committee on Vaccine Safety at 15 years. Vaccine.
2016;34:3342-9.
- Canadian Immunization Guide. Part 2. Vaccine Safety and Adverse Events Following Immunization. Public Health Agency of Canada.
- Centers for Disease Control and Prevention. Statement Regarding Rotarix and RotaTeq Rotavirus Vaccines and Intussusception. 2010.
- Centers for Disease Control and Prevention. Epidemiology and
Prevention of Vaccine-Preventable Diseases. Atkinson W, Wolfe S,
Hamborsky J (eds.). Chapter 2 General Recommendations on Immunization. 13th ed. Washington DC: Public Health Foundation, 2015.
- Centers for Disease Control and Prevention. Chart of Contraindications and Precautions to Commonly Used Vaccines. June 2018.
- Centers for Disease Control and Prevention. Rotavirus Vaccine (RotaShield) and Intussusception.
- Chao C, Klein NP, Velicer CM, Sy LS, Slezak JM, Takhar H, et al.
Surveillance of autoimmune conditions following routine use of
quadrivalent human papillomavirus vaccine. J Intern Med.
2012;271:193-203.
- Chen RT, Davis RL, Sheeedy KM. Seguridad de las vacunas. En: Plotkin
SA, Orenstein WA, Picazo JJ (eds.). Vacunas, 1.ª ed. española. Madrid:
Editorial Médica AWWE, S.L.; 2007. p. 1629-55.
- Editors of the Lancet. Retraction-Ileal-lymphoid-nodular
hyperplasia, non-specific colitis, and pervasive developmental disorder
in children. Lancet. 2010;375(9713):445.
- European Medicines Agency. European Medicines Agency recommends continued vaccination with Gardasil. Doc. Ref. EMEA/CHMP/103339/2009.
- Ezeanolue E, Harriman K, Hunter P, Kroger A, Pellegrini C. General
Best Practice Guidelines for Immunization. Best Practices Guidance of
the Advisory Committee on Immunization Practices (ACIP). 2020.
- Glass RI, Parashar UD. Rotavirus vaccines-balancing intussusception risks and health benefits. N Engl J Med. 2014;370:568-70.
- Haber P, Sejvar J, Mikaeloff Y, De Stefano F. Vaccines and Guillain-Barré syndrome. Drug Saf. 2009;32:309-23.
- IOM (Institute of Medicine). 2012. Adverse effects of vaccines: Evidence and causality. Washington, DC: The National Academies Press.
- Isai A, Durand J, Le Meur S, Hidalgo-Simon A, Kurz X. Autoinmune
disorders after immunization with influenza A H1N1 vaccines with and
without adjuvant; Eudravigilance data and literature review. Vaccine.
2012;30:7123-9.
- Loughlin AM, Marchant CD, Adams W, Barnett E, Baxter R, Black S, et
al. Causality assessment of adverse events reported to the Vaccine
Adverse Event Reporting System (VAERS). Vaccine. 2012;30:7253-9.
- Sarkanen T, Alakuijala A, Julkunen I, Partinen M. Narcolepsy
Associated with Pandemrix Vaccine. Curr Neurol Neurosci Rep.
2018;18:43.
- Scheller NM, Svanström H, Pasternak B, Amheim-Dahlström L, Sundström
K, Fink K, et al. QuadrivalentHPV vaccination and risk of multiple
sclerosis and other demyelinating diseases of the Central Nervous
System. JAMA. 2015;313:54-61.
- Stowe J, Andrews N, Kosky C, Dennis G, Eriksson S, Hall A, et al.
Risk of Narcolepsy after AS03 Adjuvanted Pandemic A/H1N1 2009 Influenza
Vaccine in Adults: A Case-Coverage Study in England. Sleep.
2016;39:1051-7.
- Taylor LE, Swerdfeger AL, Eslick GD. Vaccines are not associated
with autism: an evidence-based meta-analysis of case-control and cohort
studies. Vaccine. 2014;32:3623-9.
- Thompson WW, Price C, Goodson B, Shay DK, Benson P, Hinrichsen
VL, et al. Vaccine Safety Datalink Team. Early thimerosal exposure and
neuropsychological outcomes at 7 to 10 years. N Engl J Med.
2007;357:1281-92.
- Verstraeten T, Descamps D, David MP, Zahaf T, Hardt K, Izurieta P,
et al. Analysis of adverse events of potential autoimmune aetiology in a
large integrated safety database of AS04 adjuvanted vaccines. Vaccine.
2008;26:6630-8.
- World Health Organization. Causality assessment of an adverse event
following immunization (AEFI): user manual for the revised WHO
classification (second edition) Geneva: World Health Organization; 2018.
- World Health Organization: Global Advisory Committee on Vaccine
Safety, report of meeting held 16-17 june 2010. Wkly Epidemiol Rec.
2010;85:285-92.
- World Health Organization: Global Advisory Committee on Vaccine
Safety, report of meeting held 12-13 June 2013. Wkly Epidemiol Rec.
2013;88:301-12.
- World Health Organization. Human papillomavirus vaccines: WHO position paper, October 2014. Wkly Epidemiol Rec. 2014;89:465-91.
- World Health Organization. Meeting of the Global Advisory Committee on Vaccine Safety, 7–8 June 2017. Wkly Epidemiol Rec. 2017;92:393-402.
- World Health Organization. WHO E-learning course on Vaccine Safety Basics.
⌂
En la Unión Europea, la Agencia Europea de Medicamentos supervisa la
regulación de vacunas y otras medicinas, y un comité de la Organización
Mundial de la Salud hace recomendaciones para los productos biológicos
utilizados a nivel internacional; muchos países han adoptado las normas
de la OMS.
Etapas en el desarrollo y las pruebas de vacunas
En Estados Unidos, el desarrollo y las pruebas de las vacunas siguen
un conjunto estandarizado de pasos. Las primeras etapas son de
naturaleza exploratoria. La regulación y la supervisión aumentan en lo
que la vacuna candidata avanza en el proceso.
Primeros pasos: Estudios de laboratorio y en animales
Fase I de los ensayos con la vacuna
Fase II de los ensayos con la vacuna
Un grupo más grande de varios cientos de personas participa en las
pruebas de fase II. Algunas de las personas pueden pertenecer a grupos
en riesgo de contraer la enfermedad; los ensayos son aleatorios y bien
controlados, e incluyen a un grupo de placebo.
Las metas de las pruebas de fase II son estudiar la vacuna candidata
en cuanto a su seguridad, capacidad imunógena, dosis propuestas,
programa de vacunación y método de aplicación.
Fase III de los ensayos con la vacuna
Las vacunas candidatas que tienen éxito en la fase II avanzan a
ensayos más grandes, que involucran de miles a decenas de miles de
personas. Las pruebas de fase III son aleatorias y doble ciego, e
involucran la vacuna experimental que se prueba contra un placebo (el
placebo puede ser una solución salina, una vacuna para otra enfermedad o
alguna otra sustancia).
Una meta de la fase III es evaluar la seguridad de la vacuna en un
grupo grande de personas. Algunos efectos secundarios poco usuales
podrían no ser evidentes en grupos más pequeños de personas que formaron
parte de las fases anteriores; por ejemplo, suponga que un suceso
adverso, relacionado con una vacuna candidata, pudiera ocurrir en 1 de
cada 10,000 personas, para detectar una diferencia significativa de un
suceso de baja frecuencia, el ensayo tendría que haber incluido 60,000
sujetos, la mitad de ellos en el control, o en el grupo sin vacuna
(Plotkin SA et al. Vaccines, 5th ed. Philadelphia: Saunders, 2008).
La eficacia de la vacuna también se prueba, lo cual puede incluir los
siguientes factores: 1) ¿La vacuna candidata previene la enfermedad? 2)
¿Previene la infección por el patógeno? 3) ¿Conduce a la producción de
anticuerpos u otros tipos de respuestas inmunológicas relacionadas con
el patógeno?
Siguientes pasos: Aprobación y autorización oficial
Después de que un ensayo de fase III resulta exitoso, el creador de
la vacuna enviará a la FDA una solicitud de autorización oficial para
productos biológicos. Posteriormente, la FDA inspeccionará la fábrica
donde se producirá la vacuna y aprobará el etiquetado de la misma.
Después de emitir la autorización oficial, la FDA vigilará la
producción de la vacuna, incluyendo las instalaciones de inspección, y
revisará las pruebas que hace el fabricante a lotes de vacunas en cuanto
a capacidad para obtener el efecto deseado, seguridad y pureza. La FDA
tiene el derecho de realizar sus propias pruebas a las vacunas de los
fabricantes.
Vigilancia posterior una vez emitida la autorización oficial
Diversos sistemas vigilan las vacunas después de haber sido
aprobadas. Entre ellos se incluyen los ensayos de la fase IV, el Sistema
de Información sobre Eventos Adversos a una Vacuna (Vaccine Adverse Event Reporting System) y el Enlace de Datos sobre la Seguridad de las Vacunas (Vaccine Safety Datalink).
Fase IV de los ensayos
Los ensayos de la fase IV son estudios opcionales que pueden realizar
las compañías de medicamentos después de que se lanza una vacuna. El
fabricante puede seguir realizando pruebas a la vacuna en cuanto a
seguridad, eficacia y otros posibles usos.
VAERS
En 1990, los CDC y la FDA establecieron el Sistema de Información sobre Eventos Adversos a una Vacuna (VAERS,
por sus siglas en inglés). El objetivo de VAERS, de acuerdo con los
CDC, es “detectar posibles señales de reacciones adversas relacionadas
con las vacunas” (en este caso, una señal es una prueba que indique una
posible reacción adversa observable a través de los datos recopilados).
Cada año se notifican aproximadamente 30,000 sucesos a VAERS. Entre un
10 y un 15% de estas notificaciones describen reacciones médicas graves
que terminan en: hospitalización, enfermedades que ponen en peligro la
vida, discapacidad o muerte.
VAERS es un sistema de notificación voluntaria, cualquier padre,
proveedor de cuidado médico o amigo del paciente que sospeche una
relación existente entre una vacuna y una reacción adversa, puede hace
una notificación a VAERS. Posteriormente, los CDC investigan el suceso y
tratan de descubrir si la reacción adversa fue realmente ocasionada por
la vacuna.
Los CDC declaran que dan seguimiento a los datos del VAERS para:
- Detectar reacciones adversas que sean nuevas, inusuales o raras
- Vigilar el aumento en reacciones adversas conocidas
- Identificar posibles factores de riesgo para el paciente en tipos particulares de reacciones adversas
- Identificar lotes de vacunas cuando aumenten las cifras o los tipos de reacciones adversas notificadas
- Evaluar la seguridad de vacunas cuya autorización oficial se otorgó recientemente
No todas las posibles reacciones adversas notificadas a VAERS son provocadas por
una vacuna; los dos incidentes podrían estar relacionados únicamente
por el tiempo, y es probable que no todas las reacciones adversas que
sean resultado de una vacuna se informen a VAERS. Los CDC declaran que
muchas reacciones adversas, como la inflamación en el sitio de la
inyección, no se notifican. De acuerdo con los CDC, las reacciones
adversas graves “probablemente tienen más probabilidades de notificarse
que las leves, en especial cuando ocurren poco después de la vacunación,
aunque tal vez sean coincidencias y se relacionen con otras causas”.
VAERS ha identificado con éxito diversas reacciones adversas raras relacionadas con la vacunación. Entre ellas se encuentran:
- Un problema intestinal después de que se introdujo la primera vacuna para el rotavirus en 1999
- Enfermedades neurológicas y gastrointestinales relacionadas con la vacuna contra la fiebre amarilla
Además, de acuerdo con Plotkin et al., VAERS identificó la
necesidad de investigar más a fondo la relación de la MMR con un
trastorno de coagulación de la sangre, encefalopatía después de la MMR, y
un síncope después de la vacunación (Plotkin SA et al. Vaccines, 5th ed. Philadelphia: Saunders, 2008).
Enlace de Datos sobre la Seguridad de las Vacunas
En 1990, los CDC establecieron este sistema, el Enlace de Datos (VSD,
por sus siglas en inglés) es una recopilación de bases de datos
enlazadas que contienen información de grupos médicos grandes. Las bases
de datos enlazadas permiten que los funcionarios recopilen datos sobre
vacunación entre las poblaciones que atendieron los grupos médicos. Los
investigadores pueden tener acceso a los datos si proponen estudios a
los CDC, y estos otorgan la aprobación.
El VSD presenta algunas dificultades; por ejemplo, la base de datos
incluye a pocos niños sin vacunar; los grupos médicos que suministran
información al VSD podrían tener poblaciones de pacientes que no
representen a poblaciones grandes en general; además, los datos no
provienen de ensayos aleatorios, controlados y ciegos, sino de la
práctica médica real. Por lo tanto, podría ser difícil controlar y
evaluar los datos.
El Análisis Rápido de Ciclo (RCA, por sus siglas en inglés) es un
programa de VSD que inició en 2005 y vigila datos en tiempo real para
comparar tasas de reacciones adversas en personas recién vacunadas con
tasas en personas no vacunadas; el sistema se utiliza principalmente
para dar seguimiento a nuevas vacunas. Entre las nuevas vacunas que
tienen seguimiento en el Análisis Rápido del Ciclo se encuentran la
vacuna meningocócica conjugada, la vacuna contra el rotavirus, la vacuna MMRV,
la vacuna Tdap y la vacuna HPV. Posteriormente se estudian más a fondo
las posibles relaciones entre reacciones adversas y la vacunación.
En conclusión
Las vacunas se desarrollan, prueban y regulan de manera muy similar a
otros medicamentos. En general, las vacunas cuentan con pruebas más
meticulosas que los medicamentos porque, por lo general, es mayor la
cantidad de humanos en los ensayos clínicos de las vacunas. Además, el
seguimiento de las vacunas, después de que se otorga la autorización
oficial, se examina minuciosamente por los Centros para el Control de
Enfermedades (CDC) y la FDA.
Enlaces de interés
VAX. Understanding vaccine trials: How are AIDS vaccines tested?. IAVI Report. Vol. 1, no. 1. agosto 2003. Acesado el 17 enero 2018.
Plotkin, S.A., Orenstein, W.A., Offit, P.A., eds. Vaccines, 5th ed. Philadelphia: Saunders, 2008. Chapters 3 and 73.
Vaccine Development Table. The Children’s Vaccine Initiative: Achieving the Vision. National Academies Press. Acesado el 17 enero 2018.
U.S. Department of Health and Human Services. Vaccine product approval process. U.S. Food and Drug Administration. Actualizado 09 enero 2018. Acesado el 17 enero 2018.
U.S. Department of Health and Human Services. Investigational New Drug (IND) Application. U.S. Food and Drug Administration. Actualizado 05 octubre 2017. Acesado el 17 enero 2018.
Lilienfeld, D.E. The first pharmacoepidemiologic investigations: national drug safety policy in the United States, 1901-1902. Perspectives in Biology and Medicine. 51.2 (2008): 192-96.
https://articulosclaves.blogspot.com/2021/03/no-es-alarmismo-es-seguir-los.html
https://notistecnicas.blogspot.com/2021/01/asi-funcionan-las-vacunas-de-arn.html?fbclid=IwAR3MvTyY8mWs3g3fDbgayvfh8-uFpJHjy3R_E1iPIR4n1XTD3c_KtxPtLsE
https://notistecnicas.blogspot.com/2021/01/por-que-la-vacuna-de-la-covid-19-es-la.html?fbclid=IwAR0QG5-gRQFXVQXDFCskz5BlewGesmmTJAeDLjr7OiRgsIamNP-KXDu4RVY
https://notistecnicas.blogspot.com/2020/12/la-rapidez-en-encontrar-una.html?fbclid=IwAR2wTnWjJgvw7g73oYGsS6WN_XspML6GxUnj4guOFux0tgnQGEhPIO6yelg
https://notistecnicas.blogspot.com/2020/12/de-hungria-un-futuro-nobel-retrato-de.html?fbclid=IwAR0098G1C3klKfRth1C81TP4lc5ouCHeS_vHimsT0FfckSEc6Lj2s-32GvM
https://notistecnicas.blogspot.com/2020/12/las-vacunas-contra-la-covid-el.html?fbclid=IwAR0098G1C3klKfRth1C81TP4lc5ouCHeS_vHimsT0FfckSEc6Lj2s-32GvM
https://articulosclaves.blogspot.com/2021/01/la-evolucion-de-las-vacunas-de-edward.html?fbclid=IwAR2okQhcg3nQe6SWaMYoHLCeddE7tuaNNPuEZIPi-cOZMl2t7P8uYY4fwo8
https://articulosclaves.blogspot.com/2020/09/farmaceuticas-y-vacunasapunte.html?fbclid=IwAR3MvTyY8mWs3g3fDbgayvfh8-uFpJHjy3R_E1iPIR4n1XTD3c_KtxPtLsE
https://www.google.com/url?sa=t&rct=j&q=&esrc=s&source=web&cd=&ved=2ahUKEwij-fXux7rvAhVGShUIHZp9DtUQFjAAegQIAhAD&url=http%3A%2F%2Fwww.enfermeriacantabria.com%2Fweb_enfermeriacantabria%2Fdocs%2FVigilancia_Seguridad.pdf&usg=AOvVaw29SS6WH_--vA2ZA0OTB92g
https://www.google.com/url?sa=t&rct=j&q=&esrc=s&source=web&cd=&cad=rja&uact=8&ved=2ahUKEwij-fXux7rvAhVGShUIHZp9DtUQFjABegQIBBAD&url=https%3A%2F%2Fwww.aemps.gob.es%2FmedicamentosUsoHumano%2Fvacunas%2Fdocs%2Fvigilancia_seguridad_vacunas_COVID-19.pdf%3Fx54046&usg=AOvVaw3X7nLa0LC2S-aIdvqSF0iK
- https://www.historyofvaccines.org/index.php/es/contenido/articulos/desarrollo-pruebas-y-reglamentos-para-las-vacunas
- https://www.aemps.gob.es/la-aemps/ultima-informacion-de-la-aemps-acerca-del-covid%E2%80%9119/vacunas-contra-la-covid%E2%80%9119/farmacovigilancia-de-vacunas/
- https://www.aemps.gob.es/medicamentosUsoHumano/vacunas/docs/vigilancia_seguridad_vacunas_COVID-19.pdf?x69995
"Ayer en Galicia no se presentaron a la vacunación un tercio de los llamados. Hay una probabilidad mucho más alta de que alguno de esos no vacunados muera por la Covid que de que alguno de los vacunados tenga algún efecto secundario grave. Pero el daño ya está hecho. El principio de precaución aplicado en este caso no ha hecho sino exacerbar el miedo. Nunca sabremos nada de esos muertos que ayer no se quisieron vacunar, ni de los de mañana o pasado. Los medios no les dedicarán ni un solo titular sensacionalista".Antonio Diéguez
La Covid-19 vuelve a levantar la cabeza cuando parecía que la teníamos acorralada a nivel mundial. Se acelera los contagios con 529.000 más en un solo día 82.000 más que hace dos semanas. Brasil en record con 90.328. Europa descontrolada. India 36.000. EEUU sube un poco 63.000.
.
Los nuevos contagios crecen a un ritmo de 546.000 diarios 99.000 más que hace dos semanas.
.
Europa ya representa la mitad de los nuevos contagios que se produce por Covid. Italia, Francia, Polonia, Chequia etc. están el plena expansión.
- https://elpais.com/sociedad/2021-03-18/macron-ordena-el-confinamiento-de-paris-y-otros-15-departamentos.html?utm_source=Facebook&ssm=FB_CM&fbclid=IwAR11o6aZvZgBHFDlF0rNWhyHSvRRE86jBiIihB7IK4767CNzwHCBLS3zZ-s#Echobox=1616096377
Alemania está en una posición intermedia pero subiendo. España era la que mejor evolución tenía pero las tornas están cambiando.








