Una inteligencia artificial predice la interacción entre todas las moléculas de la vida
La empresa que controla Google crea una farmacéutica para descubrir nuevos medicamentos en la mitad de tiempo
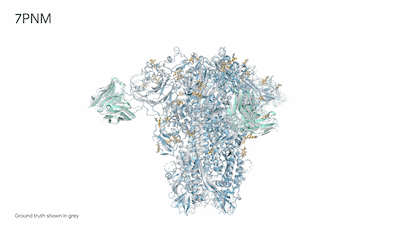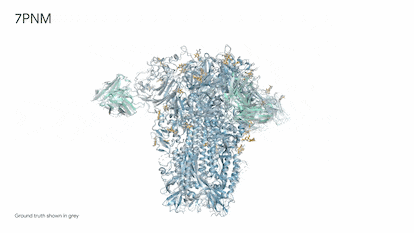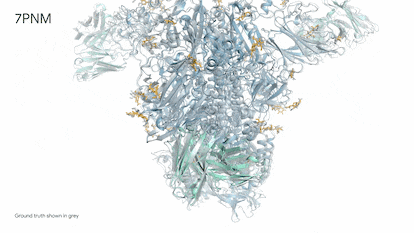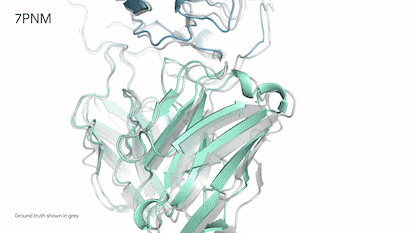
Demis Hassabis, hijo de un grecochipriota y una singapurense criado en Londres, es un prodigio del ajedrez. Comenzó a jugar a los cuatro años y a los 13 ya era un maestro. Estudió informática, se doctoró en neurociencia y fundó Deepmind, que actualmente es el puntal de inteligencia artificial, o IA, de la empresa propietaria de Google. Hace unos días, Hassabis, de 47 años, recordaba en una entrevista el día en que fue totalmente consciente de la potencia imparable de esta tecnología. Una mañana de 2018, mientras se tomaba un café, le echó una partida a AlphaZero, la IA de ajedrez que había creado. Pudo ganarla sin muchos problemas. En unas horas, el programa, que se ensañaba a sí mismo jugando cientos de miles de partidas, ya estuvo a punto de vencerle. Por la noche ya era “el mejor jugador de ajedrez que jamás haya existido”. Todo en apenas nueve horas. “Fue asombroso verlo en directo. Era inevitable preguntarse ¿qué podrá hacer este sistema en ciencia o cualquier otro problema complejo?”, explica.
El tiempo de los juegos ha terminado. Desde 2020, Alphafold, la inteligencia artificial ideada por Hassabis ha superado a cualquier humano en problemas endiablados de biología y determinado la estructura tridimensional de 200 millones de proteínas, prácticamente todas las que se conocen. Resolver la forma de una sola proteína puede llevar varios años de dedicación de un estudiante de doctorado, por lo que la IA habría ahorrado de golpe unos mil millones de años de trabajo.
El empresario ofreció ayer una rueda de prensa para presentar su nueva creación: Alphafold 3. Por primera vez, una IA puede predecir la interacción entre proteínas y el resto de moléculas esenciales de la vida: ADN y ARN, moléculas pequeñas —medicamentos— y anticuerpos, las proteínas diminutas del sistema inmune especializadas en luchar contra virus, bacterias, incluso tumores. “La biología es un sistema dinámico y sus propiedades emergen precisamente de interacciones entre las diferentes moléculas que componen la célula. Alphafold 3 es nuestro primer gran paso para entenderlas”, explicó Hassabis. Los detalles de este nuevo sistema de IA se publican hoy en Nature, referente de la mejor ciencia mundial. La compañía de Google abrirá además un servidor gratuito para que los científicos puedan usar esta nueva herramienta.

La derivada más evidente del nuevo sistema es su potencial para descubrir nuevos fármacos, un campo que a partir de ahora explorará, esta vez en el ámbito privado, Laboratorios Isomorphic, una filial de Alphabet (propietaria de Google) liderada por Hassabis. Con la ayuda de Alphafold 3 y desarrollos adicionales propios, el sabio de Google espera reducir a la mitad el tiempo que se tarda en descubrir un medicamento antes de comenzar los ensayos en pacientes, de los cinco años actuales a apenas dos, según explicó a Financial Times. La compañía ya ha firmado dos contratos de colaboración con las multinacionales Lilly y Novartis, que han aportado de entrada decenas de millones de dólares y prometen varios miles de millones más cuando haya resultados.
El químico estadounidense John Jumper, director de Deepmind, aseguró ayer que el nuevo sistema es muy superior a sus rivales. Alphafold 3 predice con éxito el 76% de casos de interacción entre proteínas y moléculas pequeñas, frente al 52% de la siguiente mejor herramienta, señaló. En la unión de proteínas al ADN o su interacción con anticuerpos duplica la capacidad de los métodos convencionales. La nueva IA permite un nuevo nivel de predicción sobre lo que sucede dentro de las células y qué se tuerce cuando hay daño en el ADN. “Esto tiene implicaciones para entender el cáncer y desarrollar nuevas terapias”, resaltó Jumper, pero también para entender la respuesta de las plantas a patógenos y olas de calor, esencial para garantizar la seguridad alimentaria.
El nivel de complejidad a explorar por este nuevo sistema es “absolutamente descomunal”, en palabras de Max Jaderberg, jefe de IA de Laboratorios Isomorphic. Solo en lo que respecta a moléculas pequeñas, las más interesantes en farmacología, hay unas 10 a la sexagésima potencia, muchas veces más que estrellas en todo el universo.
Frente a este Goliat de la IA, el bioquímico estadounidense David Baker hace honor a su nombre. El investigador lidera una iniciativa pública y completamente abierta para crear inteligencias artificiales capaces de predecir procesos bioquímicos e inventar nuevos compuestos con propiedades específicas.
Hace dos meses, sin que tuviese impacto mediático, Baker publicó en Science su nueva IA, que reconstruye moléculas átomo a átomo, predice su unión al ADN, y diseña compuestos nuevos que no existían en la naturaleza. “Los creadores de Alphafold 3 dicen que tiene más precisión que nuestro sistema”, explica Baker en un correo electrónico. “Creo que tendrá un gran impacto, aunque no consiguen diseñar nuevas proteínas”, añade.
El investigador de la Universidad de Washington (Estados Unidos) resalta otra importante diferencia. “Deepmind no publica el código [de su IA], lo que difiere de la práctica habitual en ciencia”, resalta. Conocer el código base de una IA permite que la comunidad pueda modificarla y darle nuevas capacidades, mientras que un servidor solo permite usarla dentro de los límites fijados por su creador.
Al igual que otros sistemas de IA como ChatGPT, Alphafold tiene alucinaciones, —se inventa algunos resultados— sobre todo cuando describe cosas de las que no hay información en las grandes bases de datos con las que se entrena.
Una proteína humana puede ser un auténtico monstruo microscópico con decenas de miles de aminoácidos —sus ladrillos básicos— que se doblan sobre sí mismos para formar anzuelos, tirabuzones, pinzas y otras partes móviles que cambian de posición cuando una proteína se une a otra molécula. La nueva IA alucina sobre todo al describir las “zonas desordenadas” de las proteínas, regiones sin una forma tridimensional fija, que son esenciales para entender estas interacciones. “Son como la materia oscura de las proteínas”, resume Mafalda Dias, investigadora del Centro de Regulación Genómica, en Barcelona, comparando estas regiones con el ingrediente desconocido que compone el 25% del universo. “El modelo se ha entrenado con estructuras tridimensionales estáticas, pero como la biología es dinámica, el resultado que propone puede ser muy diferente a la realidad. Los creadores de Alphafold han sido muy francos respecto a estas y otras limitaciones”, destaca la científica portuguesa.
El biólogo Rafael Fernández Leiro, que ha dedicado su vida académica y profesional al estudio de la biología estructural a través de la cristalografía y la microscopía electrónica, pone un ejemplo para entender el potencial de descubrimiento de Alphafold 3. “Dentro de las células hay un cóctel complejísimo de proteínas, ácidos nucleicos, lípidos, proteínas especializadas como las enzimas que permiten copiar y leer el ADN y producir a su vez otras proteínas. Hasta ahora solo podíamos establecer la estructura de proteínas aisladas, pero ahora las podemos estudiar unidas a otras, a ADN, ARN, incluso explorar qué sucede si modificamos el conjunto con un residuo de fosfato, o fosforilación [una modificación epigenética] que cambia la función de todo el conjunto. Esto va a ser un generador de hipótesis asombroso. Eso sí, al final habrá que confirmar los resultados usando las técnicas convencionales y aquí vendrá lo difícil, porque si este sistema acierta en casi el 80% de los casos, quiere decir que falla en el 20%, un porcentaje demasiado alto para gastar el dineral que cuesta llevar un fármaco a ensayos con pacientes. Pero sí va a marcar una gran diferencia en las primeras fases de búsqueda de nuevos fármacos”, detalla.
El bioinformático navarro Íñigo Barrio, que trabaja en el Instituto Welcome Sanger (Reino Unido), destaca la nueva capacidad de esta IA para explicar cómo las proteínas se unen entre ellas o a otras moléculas para formar complejos. Un ejemplo clásico es cómo la hemoglobina se une a su ligando, el oxígeno, para transportarlo por todo el cuerpo. “Lo más relevante va a ser la capacidad de predecir la unión de diversos ligandos a proteínas. Permite entender dónde y cómo se va a unir un fármaco a la proteína diana, cómo va a afectar a su biología y los efectos potenciales no deseados en otras proteínas”, resalta.
En la entrevista que dio hace unos días para TED, le preguntaron a Hassabis cuál es el siguiente gran problema que quiere abordar con la IA. El neurocientífico contestó que cuando se haya construido la Inteligencia Artificial General —capaz de resolver muchos problemas diferentes a la vez— le gustaría usarla para entender la naturaleza en su nivel más fundamental, a la escala de Planck, en la que suceden los alucinantes fenómenos cuánticos. “Es algo así como la escala de resolución de la realidad”, señaló.
"'Nature' no debería publicar estudios así"
Alfonso Valencia, director de ciencias de la vida en el Centro Nacional de Supercomputación, es crítico con la nueva aportación de Deepmind, aunque reconoce que "sin duda supone un progreso importante". "Muestran que un modelo general de predicción de complejos de macromoleculas es posible, lo comparan con métodos anteriores, principalmente de David Baker, su único competidor serio, y muestran mejoras significativas, aunque basadas en pocos casos, docenas en cada categoría, lo que hace los resultados mucho menos fiables", señala.
"El problema obvio es que al ofrecerse en un servidor, los usuarios tenderán a ignorar las limitaciones y tomar los resultados como fiables en todos los casos. Este problema no es nuevo y servidores anteriores de predicción de estructura ya sufrían de interpretaciones abusivas. Ahora, con nuevos métodos que son más populares, potentes y visibles, el problema va a ser peor.
Aunque se puede usar el método como servidor web, no hacen el software público.
Esto es un error y 'Nature' no debería publicar estudios con resultados que no pueden ser ni reproducidos, ni validados independientemente. No puede ser una cuestión de fe creerse o no los resultados que presentan", dice.
El experto continúa: "Finalmente, veremos como el mundo académico puede adaptarse a este nuevo cambio y cuánto tiempo tardaremos en tener métodos equivalentes abiertos y públicos. Si nos basamos en los casos anteriores, como Alphafold 2, yo diría que muy poco. Entonces tendremos una evaluación más fiable e independiente de capacidades y limitaciones".
https://elpais.com/ciencia/2024-05-08/una-inteligencia-artificial-predice-la-interaccion-entre-todas-las-moleculas-de-la-vida.html?ssm=TW_CC#
https://www.lavanguardia.com/ciencia/20240508/9623004/llega-alphafold-3-ia-transformara-investigacion-biomedica.html

No hay comentarios:
Publicar un comentario